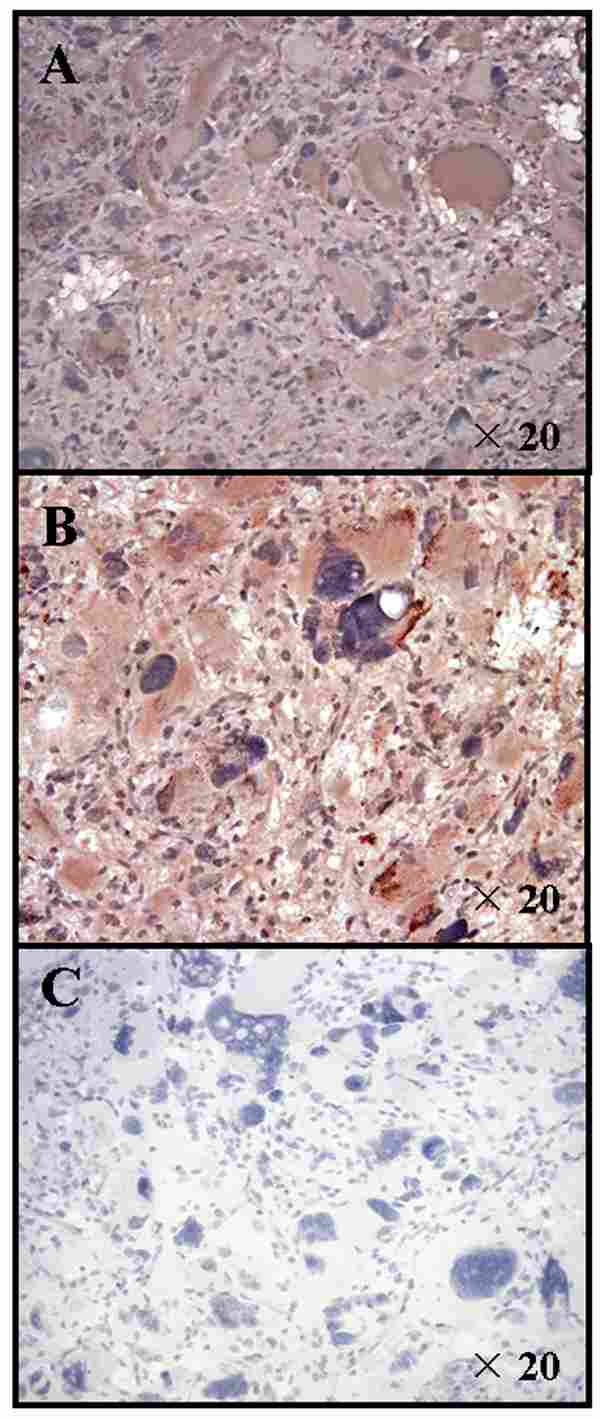
Glioma de alto grado
Epidemiología
Son los tumores cerebrales intraaxiales más frecuentes, predominantes en personas de raza blanca y en la quinta década de vida.
Clasificación
Etiología
Se han descrito multitud de factores etiológicos como la exposición a corrientes eléctricas, el uso de teléfonos móviles pero de todos ellos el único factor etiológico descrito como causante de un glioma de alto grado es la exposición crónica a derivados petroquímicos.
Fisiopatología
Se diseminan principalmente a través de la sustancia blanca o por el líquido cefalorraquídeo.
A diferencia del resto de las neoplasias malignas avanzadas, éstas no dan metástasis a distancia.
Los gliomas malignos son tumores altamente vascularizados.
Anatomía Patológica
Los gliomas de alto grado se clasifican en grado tres y cuatro y según Kernohan el grado 3 presenta atipias celulares mitosis y proliferación endotelial vascular.
El grado 4 presentaría además necrosis.
Según Daumas-Dauport el astrocitoma anaplásico presenta dos de estas características y el glioblastoma multiforme tres o cuatro de estos criterios.
Alteraciones Genéticas.-
En el desarrollo están implicados numerosos genes. Los estudios de pérdida de heterozigosidad (LOH) constituyen el método más ampliamente usado, desde el punto de vista molecular, para determinar la pérdida de material genético
1.-Pérdida de heterozigosidad (LOH) del cromosoma 10. 2.-Alteración gene p53-gene 3.-Amplificación gen-EGFR.
La combinación de la amplificación gen-EGFR y pérdida de heterozigosidad (LOH) del cromosoma 10, son de peor pronóstico.
Tumor difuso, infiltrante caracterizado por anaplasia dispersa y elevado potencial proliferativo, por lo general proceden de un astrocitoma de bajo grado aunque pueden ser diagnosticados sin un precursor.
Igualmente, tienen un potencial intrínseco de progresar a un glioblastoma maligno.
Clínica
La clínica de estos tumores viene dictada por la compresión que produce, la destrucción parenquimatosa , el bloqueo de la circulación del líquido cefaloraquídeo así como la compresión vascular .
Se caracteriza por el déficit neurológico progresivo.
Un 50% presentan cefaleas de carácter matutino acompañado de náuseas y vómitos.
Un 30% de los casos presenta una crisis epiléptica.
Pueden haber alteraciones psiquiátricas en el sentido de cambios de carácter
Compresión de Pares craneales
Deterioro brusco del nivel de conciencia por hemorragias edema peritumoral masivo, hidrocefalia por obstrucción del líquido cefaloraquídeo.
Puede haber también síndrome de isquemia transitorias por obstrucción de vasos.
Diagnóstico
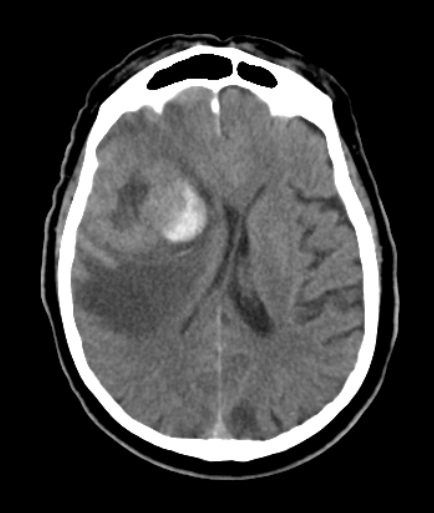
Se debe realizar TAC y/o resonancia nuclear magnética con contraste.
Masa con necrosis en el centro a nivel del lóbulo frontal derecho de 5.1 cm de tamaño con zona de sangrado en su vertiente medial unos 25×16 mm con importante edema vasogénico, en probable relación con glioma de alto grado o menos probable metástasis.
Condiciona efecto de masa sobre el ventrículo lateral derecho, colapsándolo parcialmente, y desvía la línea media unos 9 mm hacia la izquierda, con signos de herniación subfalciana y mínima uncal derecha.
Los hallazgos los subdividiremos en cuatro grados de Kernohan:
El grado tres que se caracteriza por captación de contraste sin efecto masa y el cuarto grado por captación de contraste y efecto masa.
Glioblastoma parietal sin y con contraste.
Diagnóstico diferencial
El diagnóstico diferencial habrá que realizarlo con todos las lesiones que captan contraste en anillo como son la metástasis, absceso cerebral pero también con infarto cerebral y linfoma.
Tratamiento
Se basa generalmente en combinar el tratamiento quirúrgico, la radioterapia (RT) y la quimioterapia (QT). La temozolomida (TMZ) es el principal agente quimioterápico empleado 1) 2) 3).
Cirugía
ver Ejemplo de abordaje temporal y craneotomía temporal.
Los protocolos de tratamiento para los tumores recurrentes siguen estando mal definidas.
Los estudios han demostrado que altas dosis de radiación consiguen resultados más eficaces de control del tumor, pero a costa de radionecrosis y otros efectos secundarios. A pesar de las técnicas de estereotaxia y precisión, los estudios publicados sobre radiocirugía estereotáctica en gliomas de alto grado no han sido unánimes, con ensayos de gran tamaño que no muestra ningún beneficio de supervivencia en comparación con la radioterapia convencional (Taw y col., 2012).
Una evidencia creciente sugiere que los tumores del sistema nervioso central derivan de células madre neurales proliferativamente activas.
Estas células madre del cáncer, también identificadas en otros tumores, son un reservorio de células con capacidades de auto-renovación, y son responsables de las recurrencias después de la terapia quirúrgica, radioterapia y quimioterapia.
La única manera de controlar con éxito los gliomas malignos recurrentes en un futuro es mediante la combinación estándar de quimioterapia con la inmunoterapia. A pesar de las aparentes mejoras de los tratamientos actuales, se debe tener en cuenta que los gliomas recurrentes pueden desarrollar un “mecanismo de escape” en contra de los tratamientos.
Por lo tanto, el uso de estas terapias puede inhibir o al menos frenar la proliferación, pero las células madre puede propiciar la invasión furtiva y la proliferación de gliomas malignos más agresivos (Florian y col., 2011).
El tratamiento quirúrgico va a depender de la localización del tumor la edad del paciente y el grado de Karnofski.
En localizaciones no elocuentes se realizará una citoreducción lo más amplia posible seguida de un régimen de radioterapia que consiste en una aplicación de 60 Gy (veinte Gy sobre el hecho tumoral y 40 Gy holocraneales).
Se puede además realizar un régimen de quimioterapia consistente en:
1.- Temozolamida
2.- Carmustine endovenoso o Taxol (NABTT),-amino-camptothecan (NABTT), PCV etc…
El tratamiento quimioterápico, particularmente con nitrosoureas, se ha mostrado sólo parcialmente eficiente.
Otros tratamientos.- Proton beam radiosurgery Boron-neutron capture Terapia génica etc………..
Biopsia estereotáxica en los siguientes casos:
Tumores muy pequeños Pacientes en mal estado para anestesia general.
En localizaciones elocuentes. (La diana debe ser el centro necrótico y el anillo hipercaptante)
La TMZ-BioShuttle ha mejorado radicalmente el potencial de la Temozolamida (Braun 2009).
Pronóstico
La neoangiogénesis es un factor crucial en el comportamiento maligno de tumor y el pronóstico de los pacientes.
Globalmente causan un 2 por ciento de las muertes por cáncer.
En 1949, J. Kernohan fue el primer autor en relacionar el pronóstico y la supervivencia de los pacientes con el grado histológico en los gliomas. Desde entonces se han comparado diversas clasificaciones intentando determinar cual es el valor pronóstico de los hallazgos histológicos. El diagnosticar a un paciente un glioblastoma multiforme (G.M) supone, hasta la fecha, el aventurarle un sombrío pronóstico con supervivencias que, en la mayor parte de los casos, no excederán de los 12 meses. No obstante, hemos conseguido identificar en los pacientes afectos de un G.M algunos factores que implican un mejor pronóstico, como son la edad inferior a los 40 años, la resección quirúrgica macroscópicamente completa, o un índice de proliferación celular bajo.
El glioblastoma multiforme presenta una supervivencia media a los dos años de aproximadamente 10%.
El astrocitoma anaplásico 44 %.
Son el cáncer cerebral más frecuente y más maligno, crecen rápidamente y se infiltran causando déficits neurológicos y cognitivos, y son típicamente resistentes a la radioterapia y la quimioterapia.
Los factores pronósticos más importantes que afectan a la supervivencia de los pacientes son la edad, el estado funcional preoperatorio, y la radioterapia (Kowalczuk y col., 1997).
Recientemente, cinco variables fueron identificadas como las más significativas, incluyendo la extensión de la resección, el efecto masa, el volumen de tumor, la intensidad máxima B0 (campo magnético estático generado por un equipo de resonancia magnética), y la intensidad en la región edematosa (Zacharaki y col., 2012).
También la prexistencia de obesidad y diabetes mellitus son factores de mal pronóstico independientes (Chambless y col., 2012).
Bibliografía
Braun K, Wiessler M, Ehemann V, Pipkorn R, Spring H, Debus J, Didinger B, Koch M, Muller G, Waldeck W. Treatment of glioblastoma multiforme cells with temozolomide-BioShuttle ligated by the inverse Diels-Alder ligation chemistry. Drug Des Devel Ther. 2009 Feb 6;2:289-301.
Chambless, Lola B, Scott L Parker, Laila Hassam-Malani, Matthew J McGirt, and Reid C Thompson. 2012. “Type 2 Diabetes Mellitus and Obesity Are Independent Risk Factors for Poor Outcome in Patients with High-grade Glioma.” Journal of Neuro-oncology 106 (2) (January): 383–389. doi:10.1007/s11060-011-0676-4.
Florian, I S, C Tomuleasa, O Soritau, T Timis, H Ioani, A Irimie, y G Kacso. 2011. «Cancer stem cells and malignant gliomas. From pathophysiology to targeted molecular therapy». Journal of B.U.ON.: Official Journal of the Balkan Union of Oncology 16 (1) (Marzo): 16-23.
Taw, Benedict Beng Teck, Alessandra A Gorgulho, Michael T Selch, and Antonio A F De Salles. 2012. “Radiation Options for High-grade Gliomas.” Neurosurgery Clinics of North America 23 (2) (April): 259–267. doi:10.1016/j.nec.2012.01.003.
Zacharaki, E I, N Morita, P Bhatt, D M O’Rourke, E R Melhem, and C Davatzikos. 2012. “Survival Analysis of Patients with High-Grade Gliomas Based on Data Mining of Imaging Variables.” AJNR. American Journal of Neuroradiology (February 9). doi:10.3174/ajnr.A2939. http://www.ncbi.nlm.nih.gov/pubmed/22322603.