Glioma de bajo grado
Epidemiología
Aproximadamente 40-50% de los tumores cerebrales son gliomas y de estos el 30 % son de bajo grado (Duffau y Capelle, 2004).
El promedio de edad en astrocitomas es de 35 años y en los oligodendrogliomas es de 35-40 años.
Son tumores del adulto joven, a diferencia de los de alto grado que se presentan con mayor frecuencia sobre los 50 años.
Clasificación
Se consideran glioma de bajo grado:
1. Astrocitoma de bajo grado que constituyen el 63%,
2. Oligodendroglioma el 25% y los mixtos el 12%.
4. Gangliogliomas.
La clasificación actual de gliomas de bajo grado se basa principalmente en criterios histopatológicos, y no puede predecir con exactitud el curso clínico tan variable de estos pacientes (Dahlback y col., 2011).
Anatomía Patológica
Las limitaciones de los estudios histopatológicos:
1.- Solo se consiguen muestras limitadas y en ellas quizás no se recoge la porción más maligna.
2.- Limitación por área elocuente
3.- Muchas clasificaciones y grados según el centro
4.- Variabilidad entre patólogos.
5.- La dinámica de malignización por lo menos en un 50 % de los casos.
Por lo que las decisiones tomadas a partir del resultado histológico no sean las más óptimas.
Se han propuesto varias clasificaciones histopatológicas:
Los astrocitomas de bajo grado corresponden al grado 1 y 2 de Kernohan y a los astrocitomas 2 de la clasificación de la OMS.
Se descartan de este grupo los astrocitomas infratentoriales que tienen un comportamiento biológico diferente pues su sobrevida es mucho mayor y no tienen tendencia a malignizar. Otro tanto ocurre con los llamados astrocitomas pilocíticos, que tienen larga sobrevida y no se desdiferencian. Ambos tipos constituyen tipos diferentes de gliomas, y no deben incluirse en los astrocitomas de bajo grado pues alteran las estadísticas dada sus largas sobrevidas.
En 1988, Daumas-Dupont diseñó una nueva clasificación, basada en la presencia de los siguientes cambios morfológicos: atipia nuclear, mitosis, proliferación endotelial, necrosis. Cuando no hay cambios se clasifican en grado 1, cuando hay un cambio en grado 2, dos en grado 3 y tres o cuatro en grado 4. Al relacionar los grados con la sobrevida, se logró una aproximación más cercana a la realidad que con la clasificación de Kernohan. En una serie de cerca de 300 pacientes con astrocitomas así clasificados sólo 2 resultaron ser grado 1, lo que demuestra lo excepcional que son los tumores de este grado. El 17% fue de grado 2, el 18% de grado 3 y el 65,3% grado 4. Es decir más del 80% de los astrocitomas supratentoriales son histológicamente de alto grado de malignidad. Esta clasificación permitió además separar los astrocitomas denominados malignos de la clasificación de Kernohan, en los grados 3 y 4 claramente diferenciables histológicamente, con sobrevidas también distintas, llegando en algunos tumores grado 3 a sobrevidas de 30% a los dos años, a diferencia de los grados 4 que no alcanzan a sobrevivir un año. La clasificación de Kernohan engloba a los astrocitomas 3 y 4 en un sólo grupo con sobrevida común, lo que no sería real.
Otro problema relacionado, es el que se refiere a la muestra obtenida en la biopsia, la que permite la clasificación del tumor. Se conoce que los astrocitomas pueden tener diferentes grados en distintas regiones del tumor, en consecuencia la muestra obtenida puede no ser representativa de la totalidad de éste, especialmente en biopsias con escaso material como son las obtenidas por estereotaxia. Por esto la historia natural de un tumor clasificado como de bajo grado, pudiera no ser real.
El comportamiento biológico no sólo depende del grado histológico sino de otros factores, como son: la edad, localización, índice de Karnofsky, tamaño del tumor al diagnóstico y tipo de tratamiento.
Los oligodendrogliomas también han sido clasificados en grados de acuerdo a atipias nucleares, proliferación endotelial y necrosis. Su comportamiento biológico es diferente al astrocitoma, teniendo en general una mayor sobrevida y malignizándose con menos frecuencia. Se puede decir que aquellos, histológicamente malignos tienen una sobrevida menor que los de bajo grado. Sin embargo hay excepciones, existiendo tumores de alto grado con sobrevidas prolongadas. Smith en 1983, demostró que los clasificados como de bajo grado sobrevivían en promedio 8 años, los grados intermedios 4 años y los de alto o grado 17 meses.
La desdiferenciación de los gliomas de bajo grado es un fenómeno conocido desde hace muchos años. La frecuencia del fenómeno es variable. Afra demuestra que un grupo de pacientes que fallecieron por recidiva tumoral, que en 73% había transformación maligna y en un grupo que recidivó pero no se operó 75% mostraba signos radiológicos que hacían sospechar malignización. El mismo autor demuestra que en los casos recidivados y reoperados 81.5% de los astrocitomas aumentan de grado, transformándose en glioblastomas 24%, 58% aumenta a grado 3. En oligodendrogliomas, la transformación a grado 3 ocurrió en 44% y sólo 8% se malignizó transformándose en glioblastoma. El período de tiempo en la malignización fue muy variable, entre 4 meses y 8 años, si no existen factores adversos que aceleren este proceso.
Se estima que la recurrencia tumoral ocurre en los primeros 5 años de operados, y se malignizaría un promedio, de acuerdo a varias series, de 40% de los astrocitomas.
La localización de los astrocitomas, se relaciona a la masa cerebral; son en consecuencia más frecuentes en el lóbulo frontal, luego temporal y parietal. Los oligodendrogliomas son más frecuentes en el lóbulo frontal y raros en estructuras profundas.
Clínica
En los últimos años el síntoma por excelencia que orienta al diagnóstico es la epilepsia (90%), siendo rara la hipertensión intracraneal (5-10%), gracias al uso precoz y frecuente de la tomografía computadorizada (TC) (Smits y Duffau, 2011).
La epilepsia, juega un papel importante en la presentación clínica y la calidad de vida de los pacientes con gliomas de bajo grado.
La edad menor de 38 años y la participación cortical del tumor está sociada a convulsiones (You y col., 2011).
Esto era diferente en el pasado ya que el diagnóstico se hacía tardíamente, pues los métodos en uso permitían diagnosticar sólo tumores de tamaños considerables, siendo la hipertensión intracraneal o déficit neurológico focal síntomas frecuentes.
La escala de Karnofsky es también un buen indicativo y hace relación a la independencia del individuo para realizar las actividades cotidianas; a medida que disminuye su valor, lo hace también la sobrevida.
La exploración neuropsiscológica es fundamental.
También el dominio de lateralidad del lenguaje utilizando el Inventario de Edimburgo.
Diagnóstico
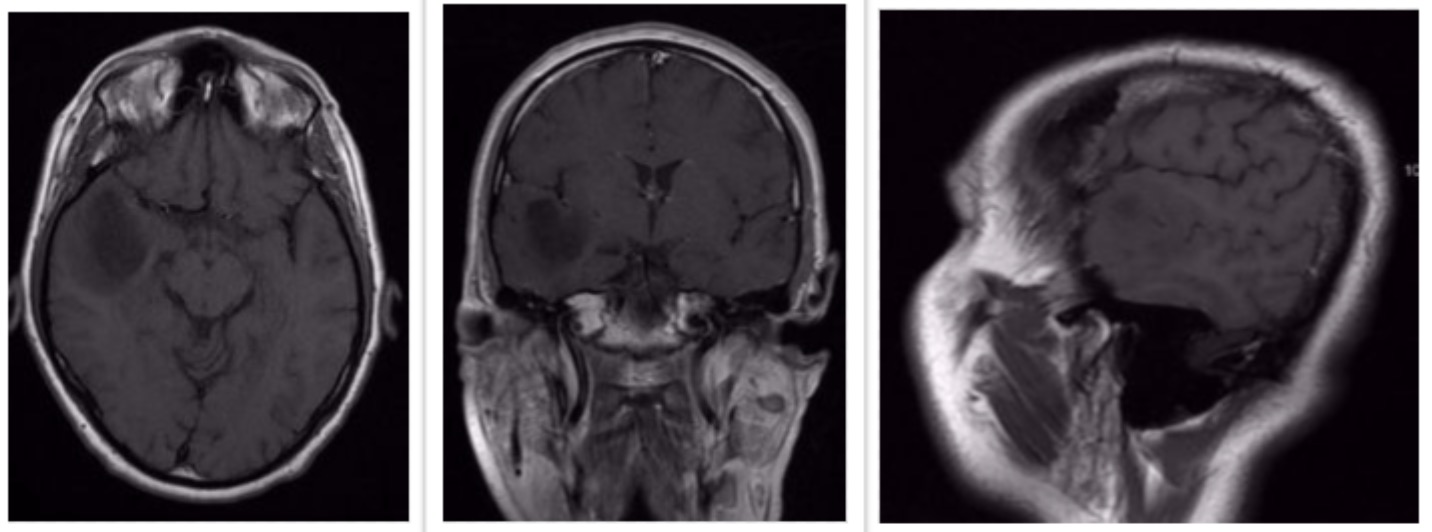
El diagnóstico de elección es la RM cerebral: Son hipointensos en T1 e hiperintensos en T2 y no suelen captar contraste. Pueden haber calcificaciones (30%) y quistes (30%).
(A) Secuencia T1 demostrando hipointensidad en el lóbulo frontal derecho. (B) secuencia T2 demostrando prolongación T2 (hiperintensidad). (C) con contraste no muestra realce marcado de contraste. Aunque estas imágenes son consideradas “típicas”, numerosos estudios han puesto en duda la fiabilidad y la precisión de estas características de imagen para el diagnóstico de glioma de bajo grado.
Se pueden realizar estudios volumétricos calculando la diferencia entre el volumen preoperatorio en secuencias T2-volumen preoperatorio en secuencias T1.
Se pueden clasificar en 3 subtipos de KELLY según la RM en T2
Kelly tipo 1 - bien definidos.
Kelly tipo 2- Áreas sugestivas de infiltración
Kelly tipo 3 - Áreas de infiltración evidente.
RM-espectroscópica
El estudio se debe de completar con la RM-Espectroscópica
RM funcional
Para evaluación de las vías motoras y del lenguaje.
RM con contraste dinámico (DCE-MRI)
Se puede utilizar para diferenciar entre tumores cerebrales de alto grado y bajo grado de forma no invasiva, y puede ser útil en la planificación. La correlación de los índices de marcadores inmunohistoquímicos sugiere que esta técnica de imagen es útil en la caracterización de los tejidos de los gliomas (Awasthi y col., 2011).
El TAC con perfusión puede revelar características histopatológicas y cambios hemodinámicos, importantes para la planificación operatoria (Zhang, Feng et al. 2007).
Con los parámetros obtenidos se correlaciona bien la histopatología del tumor, y es capaz de distinguir entre gliomas de bajo y alto grado (Xyda y col., 2011).
El PET con 18FDG: generalmente hipometabolismo.
Pronóstico
Si bien presentan una morfología microscópica benigna, casi todos tienen un comportamiento maligno, denominándoseles tumores de bajo grado y no “ benignos” como podría suponerse de acuerdo a la histología.
Es conocido que pueden permanecer en “estado latente” varios años y no dar síntomas, como también desdiferenciarse y malignizarse, siendo este proceso más frecuente en los astrocitomas.
Este fenómeno hace que la historia natural sea muy variable e impredecible y en consecuencia será difícil evaluar cualquier tratamiento que se intente.
La mayor parte de la información concerniente a la evolución se ha obtenido de series en pacientes tratados, de poca utilidad para el estudio de la evolución natural. Lo más aproximado a la historia natural sería el análisis de pacientes mínimamente tratados, como son aquellos sometidos sólo a biopsia.
En astrocitomas se estima que la sobrevida de este tipo de pacientes es de 17-30% a los 5 años y de 6-11% a los 10 años, a lo que habría que agregar el tiempo pre-diagnóstico que en promedio es de 2-4 años, lo que contrasta con los astrocitomas malignos con sobrevida a 1 año casi nula.
Cualquier tratamiento debería tener una sobrevida claramente superior al de la historia natural.
En definitiva, el patrón normal es de crecimiento continuo y la progresión sistemática a la transformación maligna, que a su vez conduce a la discapacidad neurológica y finalmente a la muerte (Duffau, 2009).
Este crecimiento pronóstico está en relación con el tipo histológico:
Mejor pronóstico:
Ganglioglioma, astrocitoma protoplásmico (algunos) ,astrocitoma pilocítico y xantoastrocitoma Pleomórfico y oligodendroglioma.
Peor pronóstico: Astrocitoma grado 2 WHO, y oligoastrocitoma.
El deterioro neurológico y finalmente la muerte es las consecuencia del progresivo crecimiento del tumor y transformación maligna y es responsable de no menos del 80 % al 90 % de muertes en estos pacientes.
Tratamiento
Exéresis de Glioma de bajo grado.
El papel de la radioterapia aún no queda bien definido.
Este tratamiento clásico, ha sido discutido en especial en tumores pequeños, que se manifiestan por crisis comiciales y localizados en zonas de difícil acceso quirúrgico (zonas elocuentes). Se ha sostenido que probablemente la simple observación, después de una biopsia estereotáxica, sería una manera acertada de enfocar este problema, pues cualquier tratamiento ofrecido, al menos debe tener mejores resultados que la historia natural.
Los gliomas tienden a infiltrar, más allá de los márgenes definidos por la radiología. Dada esta característica podría plantearse si la cirugía es un tratamiento adecuado. La respuesta se basa en que la reducción de la masa tumoral favorecería otras terapias complementarias como la radioterapia, disminuiría el efecto de masa que provocan los tumores de gran tamaño y probablemente habría menos probabilidades de malignización. Para algunos sería el ideal la pesquisa precoz del glioma a través de la RM ya que sería posible realizar una cirugía más completa, con menos secuelas neurológicas, mejor sobrevida y se trataría la epilepsia, que es el síntoma más frecuente.
La cirugía sin radioterapia en astrocitomas, da sobrevida a 5 años en 13-38% y a 10 años en 11%. Para algunos la cirugía más radical mejora el pronóstico, lo que no es compartido por otros. En oligodendrogliomas el promedio de sobrevida, sólo con cirugía es de 2 - 7 a años, con sobrevida a 5 años en 30 - 80% y a 10 años en 25 - 50%.
Los gliomas a excepción de los meduloblastomas y ependimomas, no se consideran tumores radiosensibles. En consecuencia esto, sumado al peligro de radionecrosis, hacen de la radioterapia un tratamiento de difícil manejo. Si agregamos que no existe un estudio randomizado para medir el efecto de la radioterapia en estos tumores, queda en evidencia la razón de la polémica. Sin embargo el análisis de algunas series retrospectivas permite observar que en astrocitomas la sobrevida a 5 años con radioterapia post-operatoria es del 50-60% y a 10 años de 35-40%, claramente superior a la historia natural. La dosis óptima para tratar estos tumores estaría entre 50 - 60 Gy, fraccionado en 6 a 7 semanas, con dosis semanales de 9 - 9.5 Gy en el área tumoral, evitando la irradiación del encéfalo total, e irradiando hasta 2 cms. del borde reconocible del tumor. De esta forma se intentaría evitar la radionecrosis. Dosis menores de 50 Gy no serían útiles y mayores de 60 Gy de riesgo, provocando radionecrosis. Los oligondendrogliomas operados e irradiados, también muestran una mejoría en la sobrevida, 80% sobreviven 5 años y 45 - 55% 10 años. Existe en la actualidad dos protocolos, uno europeo (EORTC) y otro norteamericano (MAYO - NCCTG), en los que se estudia en forma randomizada, la utilidad de la radioterapia, versus la simple observación, y diferentes dosis de radioterapia con fraccionamientos diferentes. Ellos podrán responder las interrogantes pendientes en relación a la discutida eficacia de la radioterapia en estos tumores radioresistentes.
De realizarse radioterapia ésta no debería efectuarse mucho tiempo después de la cirugía. El aumento del número de células hace menos eficaz la radioterapia, aumentan los focos de hipoxia en el tumor, áreas que son resistentes a la radiación y el mayor número de células hace mayor la probabilidad de transformación maligna.
Astrocitomas grado II WHO
Los pacientes con tumores que no cruzan la línea media, no implican ventrículos, confinados a un lóbulo, y que miden menos de 6 centímetros (diámetro máximo), (lo cual corresponde con los subtipos Kelly en RM cerebral) y pacientes con epilepsia pero sin déficit neurológico tienen supervivencias perceptiblemente más largas.
Cirugía
La combinación de resonancia intraoperatoria y neuronavegación funcional ayuda a maximizar la resección del tumor (Zhang y col., 2012).
Pronóstico
El grado de resección y los valores que calculan la diferencia entre el volumen preoperatorio en secuencias T2-volumen preoperatorio en secuencias T1 (ΔVT2T1), son los predictores más fuertes independientes en la mejora de la supervivencia global y el retraso de la progresión tumoral y la transformación maligna. Además, el valor ΔVT2T1 puede ser útil como un índice de predicción del grado de resección (Ius y col., 2012).
La progresión de los gliomas de bajo grado a tumores más malignos puede deberse a la combinación de un programa celular oncogénico con la supresión de la apoptosis (Doucette y col., 2010).
Ni la mutación TP53, codelecciones 1p/19q, la metilación del promotor MGMT, y la mutación IDH1 pueden predecir el curso natural de la enfermedad o la respuesta a la radioterapia o quimioterapia, o ambos (Hartmann y col., 2011).
En cambio otro estudio le da importancia a la codeleccion 1p/19q como factor pronóstico Daniels y col., 2011).
Bibliografía
Awasthi, Rishi, Ram K S Rathore, Priyanka Soni, Prativa Sahoo, Ashish Awasthi, Nuzhat Husain, Sanjay Behari, Rohit K Singh, Chandra M Pandey, y Rakesh K Gupta. 2011. Discriminant analysis to classify glioma grading using dynamic contrast-enhanced MRI and immunohistochemical markers. Neuroradiology (Mayo 4). doi:10.1007/s00234-011-0874-y. http://www.ncbi.nlm.nih.gov/pubmed/21541688.
Dahlback, Hanne-Sofie S, Ludmila Gorunova, Petter Brandal, David Scheie, Eirik Helseth, Torstein R Meling, y Sverre Heim. 2011. Genomic aberrations in diffuse low-grade gliomas. Genes, Chromosomes & Cancer 50, no. 6 (Junio): 409-420. doi:10.1002/gcc.20866.
Daniels, Thomas B, Paul D Brown, Sara J Felten, Wenting Wu, Jan C Buckner, Robert M Arusell, Walter J Curran, Ross A Abrams, David Schiff, y Edward G Shaw. 2011. Validation of EORTC Prognostic Factors for Adults With Low-Grade Glioma: A Report Using Intergroup 86-72-51. International Journal of Radiation Oncology, Biology, Physics (Mayo 5). doi:10.1016/j.ijrobp.2010.05.003. http://www.ncbi.nlm.nih.gov/pubmed/21549518.
Doucette, Tiffany, Yuhui Yang, Wei Zhang, Gregory N Fuller, Dima Suki, Daniel W Fults, y Ganesh Rao. 2010. Bcl-2 promotes malignant progression in a PDGF-B-dependent murine model of oligodendroglioma. International Journal of Cancer. Journal International Du Cancer (Diciembre 17). doi:10.1002/ijc.25869. http://www.ncbi.nlm.nih.gov/pubmed/21171016.
Duffau H, Capelle L: Preferential brain locations of low-gradegliomas. Cancer 100:2622–2626, 2004
Duffau H: Surgery of low-grade gliomas: towards a ‘functional neurooncology.’ Curr Opin Oncol 21:543–549, 2009
Englot, Dario J, Mitchel S Berger, Nicholas M Barbaro, y Edward F Chang. 2011. Predictors of seizure freedom after resection of supratentorial low-grade gliomas. Journal of Neurosurgery (Abril 1). doi:10.3171/2011.3.JNS1153. http://www.ncbi.nlm.nih.gov/pubmed/21529134.
Hartmann, Christian, Bettina Hentschel, Marcos Tatagiba, Johannes Schramm, Oliver Schnell, Clemens Seidel, Robert Stein, et al. 2011. Molecular markers in low-grade gliomas: predictive or prognostic? Clinical Cancer Research: An Official Journal of the American Association for Cancer Research (Mayo 10). doi:10.1158/1078-0432.CCR-10-3194. http://www.ncbi.nlm.nih.gov/pubmed/21558404.
Hayhurst, Caroline, Daniel Mendelsohn, y Mark Bernstein. 2011. Low grade glioma: a qualitative study of the wait and see approach. The Canadian Journal of Neurological Sciences. Le Journal Canadien Des Sciences Neurologiques 38, no. 2 (Marzo): 256-261.
Ius, Tamara, Miriam Isola, Riccardo Budai, Giada Pauletto, Barbara Tomasino, Luciano Fadiga, and Miran Skrap. 2012. “Low-grade Glioma Surgery in Eloquent Areas: Volumetric Analysis of Extent of Resection and Its Impact on Overall Survival. A Single-institution Experience in 190 Patients.” Journal of Neurosurgery 117 (6) (December): 1039–1052. doi:10.3171/2012.8.JNS12393.
Seiz, M, C F Freyschlag, S Schenkel, C Weiss, C Thomé, K Schmieder, W Stummer, y J Tuettenberg. 2011. Management of Patients With Low-Grade Gliomas - A Survey Among German Neurosurgical Departments. Central European Neurosurgery (Mayo 13). doi:10.1055/s-0031-1275351. http://www.ncbi.nlm.nih.gov/pubmed/21574128.
Smits, Anja, y Hugues Duffau. 2011. Seizures and the Natural History of WHO grade II Gliomas: a Review. Neurosurgery (Febrero 4). doi:10.1227/NEU.0b013e31820c3419. http://www.ncbi.nlm.nih.gov/pubmed/21307795.
Soffietti R, Baumert BG, Bello L, von Deimling A, Duffau H, Frénay M, et al: Guidelines on management of low-grade gliomas: report of an EFNS-EANO Task Force. Eur J Neurol 17:1124–1133, 2010
Xyda, Argyro, Ulrike Haberland, Ernst Klotz, Hans Christoph Bock, Klaus Jung, Michael Knauth, Ramona Schramm, Marios Nikos Psychogios, Gunter Erb, y Peter Schramm. 2011. Brain volume perfusion CT performed with 128-detector row CT system in patients with cerebral gliomas: A feasibility study. European Radiology (Mayo 15). doi:10.1007/s00330-011-2150-2. http://www.ncbi.nlm.nih.gov/pubmed/21573969.
Yordanova, Yordanka N, Sylvie Moritz-Gasser, y Hugues Duffau. 2011. Awake surgery for WHO Grade II gliomas within «noneloquent» areas in the left dominant hemisphere: toward a «supratotal» resection. Journal of Neurosurgery (Mayo 6). doi:10.3171/2011.3.JNS101333. http://www.ncbi.nlm.nih.gov/pubmed/21548750.
You, Gan, Zhi-Yi Sha, Wei Yan, Wei Zhang, Yong-Zhi Wang, Shao-Wu Li, Lin Sang, et al. 2011. “Seizure characteristics and outcomes in 508 Chinese adult patients undergoing primary resection of low-grade gliomas: a clinicopathological study.” Neuro-Oncology (December 19). doi:10.1093/neuonc/nor205. http://www.ncbi.nlm.nih.gov/pubmed/22187341.
Zhang, Jia-Shu, Xiao-Lei Chen, Fang-Ye Li, Jin-Jiang Li, Gang Zheng, Ting Zhang, Shen Hu, and Bai-Nan Xu. 2012. “[Influences of High-field Intraoperative Magnetic Resonance Imaging on the Extent of Resection in Low-grade Gliomas].” Zhonghua Yi Xue Za Zhi 92 (25) (July 3): 1738–1741.
Casos clínicos del Hospital General Universitario de Alicante
I7379
Varón de 46 años sin antecedentes de interés.
Fiebre y cefalea holocraneal de 4 dias de evolucion. El paciente presenta mal estar general.
Seis meses antes cuadro de cefalea en la misma localizacion de inicio brusco que se siguio a una cervicalgia.
Glasgow total: 15;
RX. TORAX PA Y LATERAL
Condensacion en LII, segmenteos posteroinferior y lateral.
TAC CRANEAL
Se aprecia edema e hinchazon que afecta a todo el lóbulo temporal derecho con borramiento de los surcos, compresion del uncus y ligera desviacion de la linea media hacia la izquierda, sin evidencia de captacion tras la administracion de contraste. Los hallazgos, dado el contexto clinico, son sugestivos de encefalitis, aunque clinicamente no lo parece.