Malformacion Arteriovenosa Cerebral
Sinónimo
Malformación arteriovenosa pial.
Es un trastorno de los vasos sanguíneos del cerebro, en los cuales existe una conexión anormal entre las arterias y las venas sin la presencia de capilares o parénquima cerebral de naturaleza congénita.
Historia
Probablemente los primeros casos publicados sobre el diagnóstico y tratamiento de las malformaciones arteriovenosas (MAV) en el sistema nervioso desde un punto de vista neuroquirúrgico son los de Cushing y Dandy a finales de la década del 20 (Kretzer, 2010).
La altísima mortalidad asociada a este tipo de patología hizo que en esa época las consideraran intratables.
El advenimiento de la angiografía, inventada por Egas Moniz en los años 30, trajo nuevas luces al entendimiento de este problema, permitiendo la visualización preoperatoria de las anomalías vasculares.
Ya en la década del 40 comienzan a aparecer publicaciones que reportan un tratamiento quirúrgico sistemático y con resultados aceptables, especialmente por el grupo de neurocirujanos escandinavos (Olivecrona y Norlén).
McKormick, en 1966, diferencia desde el punto de vista histopatológico los diversos tipos de hamartomas vasculares y establece una clasificación en grupos que se acepta hasta hoy.
Es así como distingue las MAV, las telangectasias, las malformaciones cavernosas y las malformaciones venosas, permitiendo una mejor comprensión de la historia natural de cada una de estas entidades en forma separada.
Paralelamente, en el ámbito neuroquirúrgico se comienzan a adoptar las técnicas de microcirugía utilizadas hasta entonces preferentemente por cirujanos otológicos. El trabajo de Yasagil a comienzos de la década del 70 marca un hito en este sentido revelando una estrategia del todo novedosa en la manipulación de las diversas estructuras del cerebro.
La navegación subaracnoidea preconizada por este autor, permite acceder en forma delicada y “no invasiva” a lugares profundos del encéfalo sin necesidad de atravesar parénquima sano circundante a una lesión. Esto redunda en un dramático cambio en los resultados quirúrgicos.
La técnica microquirúrgica es hoy día un standard universal en el tratamiento neuroquirúrgico de las MAV.
El ulterior desarrollo de las técnicas de diagnóstico por imagen, asociado a una mejor observación de la anatomía operatoria a través de la óptima iluminación y magnificación ofrecida por el microscopio quirúrgico, permitió hacer madurar conceptos tales como el de “vasos en pasaje”, que alimentando la MAV mediante colaterales, continúan su curso para irrigar zonas adyacentes y funcionales del cerebro y que deben por lo tanto ser identificados, aislados y respetados durante la cirugía.
Durante todos esos años se desarrollaron numerosas clasificaciones y consideraciones acerca del riesgo asociado al tratamiento quirúrgico.
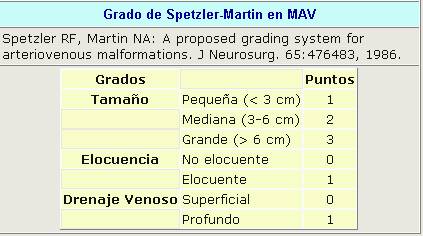
El más utilizado es el Grado de Spetzler Martin.
Ésta ha resistido la prueba del tiempo en la práctica médica para pacientes de MAV manejados quirúrgicamente, aún cuando se comparan estudios que envuelven otras modalidades de tratamiento. Recientemente, la aplicabilidad de este sistema de gradación para la evaluación de riesgo y determinación de resultados por tratamientos neuroendovasculares ha sido cuestionada (Feliciano 2010).
El tratamiento más efectivo de sigue siendo la cirugía, aunque el criterio de operabilidad en muchos casos es muy subjetivo.
Por otro lado, la cuestión principal hoy no es quién las debe controlar sino más complejo, quién puede, debe o quién quiere.
Separar las MAV ‘quirúrgicas’ de las ‘no quirúrgicas’ ayuda poco a conocer esta patología tan compleja. En la bibliografía hay buenos ejemplos de registros de poblaciones en Escocia, Finlandia, Noruega y EEUU de lo útil que puede ser recoger los datos de todas los pacientes con MAV.
Las instituciones sanitarias de las distintas comunidades autónomas deberían velar, a través de las diferentes agencias de evaluación tecnológicas, por los resultados clínicos y radiológicos de los pacientes sometidos a tratamientos ‘no quirúrgicos’, que a veces se hacen en centros concertados.
En definitiva, deberían saber si el dinero que se gastan se emplea bien. Por desgracia, estas agencias, que nosotros sepamos, se han dedicado sólo a realizar trabajos de revisión de la bibliografía; en concreto, sobre el empleo de la embolización y de la radiocirugía en las MAV.
Las MAV cerebrales son relativamente raras y deberían controlarse en centros con mucha experiencia donde neurólogos y neurocirujanos no se limiten a ser sólo buenos vecinos, sino que trabajen juntos sin separar el ictus isquémico del hemorrágico, ni las MAV ‘quirúrgicas’ de las ‘no quirúrgicas’.
En el futuro, el tratamiento endovascular, que actualmente está en manos de neurorradiólogos intervencionistas, puede depender, además, de neurólogos o neurocirujanos que también estarán capacitados para la fibrinólisis intraarterial.
La radiocirugía, que en los centros públicos tiene unas indicaciones más concretas, padece el gran inconveniente del período de latencia y que se sobreestima su efectividad porque el índice de curaciones, en la mayoría de series, se basa en los enfermos a los que se les practica una angiografía y no en el número de enfermos que se tratan.
Kondziolka et al probablemente los autores que han tratado más pacientes con MAV, realizaron en un período de 13 años radiocirugía a 805 pacientes, de los cuales sólo a 197 les practicaron un estudio angiográfico a los tres años después del tratamiento.
Los neurocirujanos que se dedican a esta patología, quieren controlar a todos los pacientes aunque no se intervinieron y así, con el patrocinio de la Sociedad Española de Neurocirugía,se está manteneniendo una base de datos de MAV.
Las peculiaridades de cada hospital hacen difícil saber quién es el que controla esta patología; sin duda debe ser conjuntamente y sin distinguir el tipo de tratamiento y, por supuesto, con registros prospectivos que nos podrán ayudar a tomar decisiones, a veces difíciles, no sólo si operar o no, sino a establecer un plan de tratamiento con varias modalidades, incluyendo la abstención terapéutica (Vilalta 2010).
Epidemiología
Tienen una incidencia de 1,12 a 1,34 por 100.000 personas-año
Son la causa primaria de hemorragia intracerebral en los jóvenes adultos.
Constituyen el 2 % de todos los ictus hemorrágicos (Choi 2005; Friedlander 2007).
Prevalencia 0,04 - 0, 52 % y leve preponderancia masculina.
El pico de presentación es de 20-40 años. El 64 % se diagnostican antes de los 40 años.
La presentación en el 50 % es hemorragia; 25 % crisis y otro 25% déficit neurológico.
El 82 % es intraparenquimatoso seguido de la hemorragia subaracnoidea, intraventricular y subdural (Challa 1995).
El riesgo de hemorragia se estima en el orden del 2.4% a 4.6% (Hernesniemi 2008).
Un 2 % son múltiples. Se ha descrito un caso de localización simétrica (Nagayama 2010).
La asociación con angioma cavernoso se ha descrito en 5 casos (Kamiyama 2010).
La literatura existente, sin embargo, no es concluyente acerca tanto de la tasa de ruptura anual y los factores que afectan el riesgo. Algunos de los inconsistencias entre las publicaciones antiguas y las recientes se explican por el uso de métodos estadísticos más sofisticados en el segundo.
Al mismo tiempo, el desarrollo de estrategias terapéuticas ha hecho cada vez más raro que una gran proporción de los pacientes se siguieran de forma conservadora, por lo tanto, las cohortes históricas de pacientes tienen un valor inherente significativo debido a la falta de sesgo de selección (Hernesniemi 2008).
Clasificación
Las malformaciones arteriovenosas varían en tamaño y en ubicación dentro del cerebro.
Algunos clasifican las MAV en piales; subcorticales; paraventriculares; combinadas.
La edad del paciente, la presentación cono hemorragia, un nido difuso, la presencia de arterias perforantes profundas, son factores importantes a la hora de seleccionar el tratamiento de los pacientes.
Una clasificación complementaria podría ayudar a predecir con mayor exactitud el pronóstico neurológico y la selección de pacientes (Lawton 2010).
Según el tamaño
Pequeñas, de 1 a 2 cm
Medianas, de 2 a 4 cm
Grandes, de 4 a 6 cm
Malformación arteriovenosa cerebral gigante de más de 6 cm.
Según la localización
Supratentoriales (85 %)
Malformación arteriovenosa temporal…
Infratentoriales (15 %)
Estas difieren en cuanto a su historia natural, diagnóstico, tratamiento, pronóstico, y otras características (Neacsu 2010).
Según el grado de Spetzler Martin
Etiología
Se desconoce la causa de la malformación arteriovenosa cerebral (MAV), pero las células endoteliales derivadas de las malformaciones arteriovenosas cerebrales sobreexpresan los factores de crecimiento proangiogénicos, y muestran un funcionamiento anormal consistente en células endoteliales muy activadas (Jabbour y col., 2009).
Los macrófagos pueden desempeñar un papel crítico en la progresión hacia la ruptura, y podría servir como un marcador de riesgo de ruptura.
Etiopatogenia
Disregulación de la angiogénesis
receptores VEGF median la proliferación endotelial, migración
Receptores de citoquinas median la maduración, remodelación vascular (Rutka 1988).
Anatomía patológica
Laas paredes vasculares presentan inflamación, infiltración celular y sobreexpresión de citocinas incluso en lesiones no rotas y sin tratar previamente.
Clínica
La hemorragia cerebral es la presentación más común, y ocurre en el 50% de los pacientes.
Normalmente, los síntomas no aparecen hasta que se presentan complicaciones, las cuales involucran una ruptura de la MAV dando como resultado un sangrado repentino en el cerebro, al cual se le conoce como Apoplejía hemorrágica, que es específicamente lo que ocurre cuando se rompe una MAV.
En un 25 % debutan con crisis comiciales
Déficit neurológico en un 20-25 %
Los primeros síntomas con frecuencia incluyen dolor de cabeza, convulsiones y otros problemas neurológicos repentinos, como son problemas de visión, debilidad, incapacidad de mover una extremidad o un lado del cuerpo, falta de sensibilidad o sensaciones normales en una parte del cuerpo.
Si la MAV sangra una vez, aumenta el riesgo de que vuelva a sangrar en el futuro. Los síntomas más comunes que se presentan primero son la hemorragia intracerebral y la hemorragia subaracnoidea.
En algunos casos, los síntomas también se pueden presentar debido a la falta de flujo sanguíneo en un área del cerebro (isquemia), a la compresión o distorsión del tejido cerebral por grandes MAV o al desarrollo anormal del cerebro en el área de la malformación. Puede haber una pérdida progresiva de las células nerviosas en el cerebro debido a factores mecánicos (presión) e isquémicos (falta de flujo sanguíneo).
Si se presentan síntomas antes de la ruptura de la MAV, estos son provocados por un pequeño y lento sangrado de los vasos sanguíneos anormales, los cuales son con frecuencia frágiles debido a su estructura anormal.
Dolor de cabeza súbito y severo localizado o general en algunos casos se asemeja a una migraña
Vómito con dolor de cabeza
Cambios en la visión- disminución de la visión- visión doble - visión borrosa sobre todo en MAV de localización occipital (Onabolu 2010).
Convulsiones - convulsiones parciales (focalizadas) - convulsiones tónico clónicas generalizadas
Debilidad muscular, en cualquier parte del cuerpo
Disminución de la sensibilidad, en cualquier parte del cuerpo.
Cambios en el estado mental
Trastornos del nivel de concirencia
Rigidez en el cuello
Otros síntomas que pueden estar relacionados con esta enfermedad son:
Deterioro del lenguaje
Deterioro del sentido del olfato
Movimiento disfuncional
Desmayos
Parálisis facial
Párpado caído
Ruidos o zumbidos en el oído
Vértigo.
Diagnóstico
Con el aumento de las imágenes de rutina y mejoras en estudios de diagnóstico no invasivos, ha habido un aumento en el diagnóstico de las malformaciones arteriovenosas incidentales.
Radiografía simple de cráneo
Sólo era útil para demostrar la presencia de algunas calcificaciones intracraneanas, se han publicado algunos casos con destrucción de cráneo (Lukic et al. 2011)
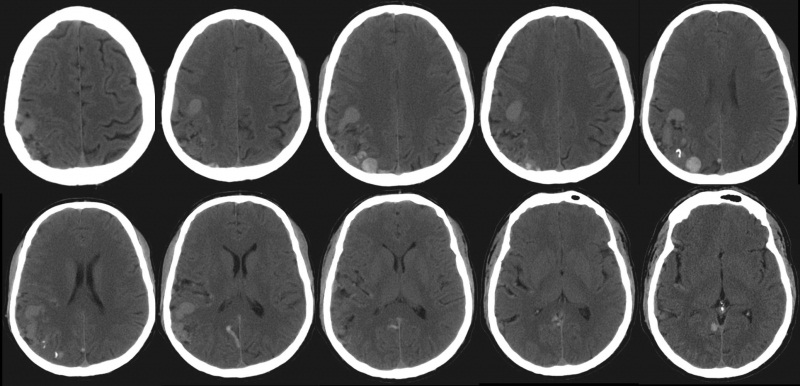
TAC sin contraste
Vasos serpinginosos iso/hiperdensos
Ca ++ en 25-30 %
Hemorragia variable
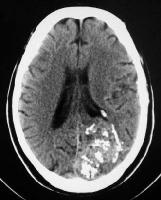
Masa heterogénea del parénquima con topografía principalmente lobular (posterior parietal derecha), con cierta extensión temporal y occipital, y con áreas hiperdensas alrededor.
Calcificaciones y estructuras serpiginosas hiperdensas y dilatadas.
TAC con contraste
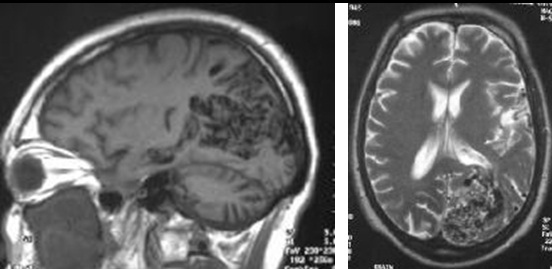
RM
Panal de vacíos de señal
La resonancia con Ferumoxytol se ha utilizado para evaluar la carga de células inflamatorias y tiene el potencial de servir como un biomarcador (Hasan y col., 2012).
Angiografía cerebral
El examen de elección es la angiografía cerebral. Este examen permite ver datos morfológicos de la lesión, especialmente los vasos aferentes, debe observarse el número de arterias nutricias. Esto es importante para la planificación de la cirugía o de la terapia endovascular. Verificar si existen vasos de “pasaje”. Ver las anastomosis con ramas de carótida externa o de cinculación posterior, si hay aneurismas asociados, fístulas de llenado precoz y espasmo arterial.
Analizar además las características morfológicas del nido y en el sistema de drenaje venoso y definir si este último está principalmente orientado al territorio superficial o al profundo.
En los casos que exista la sospecha de una malformación angiográficamente oculta se practicará RM.
Una vez establecido el diagnóstico se clasificarán según: Grado de Spetzler-Martin en
Complicaciones
Hemorragia
El riesgo anual de hemorragia es de aproximadamente 2 a 4% por año con un riesgo de por vida, entre el 17 y el 90%.
A pesar de estos cálculos generales, las malformaciones arteriovenosas no son lesiones homogéneas y un riesgo anual de hemorragia pueden variar basado en gran medida en las características del paciente y su malformación.
Además, estudios previos han encontrado que la hemorragia se asoció con un riesgo de 10 a 30% de mortalidad y del 30 al 50% de tasa de morbilidad, pero otros estudios han argumentado que estas tasas pueden ser sobreestimadas
Se han realizado varios estudios poblacionales prospectivos (New York Islands Project, Olmsted County Minnesota Study, y el Scottish Intracranial Vascular Malformation Study (SIVMS)) pero se carece de estudios a gran escala y a largo plazo.
Tratamiento
ver Exéresis de malformación arteriovenosa intracraneal.
El tratamiento quirúrgico puede ser necesario en pacientes con hemorragia intracerebral con efecto de masa significativo, pero en pacientes con malformaciones arteriovenosas no rotos el mejor tratamiento no está claro.
En pacientes con malformaciones arteriovenosas incidentales, los beneficios del tratamiento, la mejor modalidad terapéutica, el riesgo de hemorragia y el resultado a largo plazo tras el tratamiento y la hemorragia son controvertidos. Muchos posibles sesgos pueden confundir estos estudios de resultados incluyendo el sesgo de selección, el sesgo de tratamiento y seguimiento incompleto.
Poco se sabe todavía acerca de su historia natural, sus mecanismos patogénicos y la eficacia y los riesgos de los tratamientos propuestos. Se sabe que sólo la oclusión completa de la MAV puede excluir el riesgo futuro de hemorragia y que las tasas de embolización curativas de las MAV con un riesgo aceptable oscilan entre el 20 a 50%.
Con esta premisa en mente, paralelamente al tratamiento quirúrgico de las MAV, se han visto desarrollar una serie de técnicas complementarias y alternativas que han modificado en forma sustancial la estrategia de tratamiento. Entre ellas debemos destacar fundamentalmente dos: la neurorradiología intervencionista y la Radiocirugía.
Hoy día no es posible considerar un enfoque moderno del tratamiento de las MAV teniendo en cuenta sólo una modalidad de tratamiento. El concurso combinado de estas tres opciones ha demostrado conducir a los mejores resultados finales.
Sobre todo las MAV grandes precisan de un periodo larga de tiempo para la obliteración y es en estos casos donde el trabajo multidisciplinario es más necesario (Zabel-du Bois, Milker-Zabel et al. 2006).
Embolización
Los avances recientes en técnicas de catéter y los nuevos materiales, como la embolización con Onyx (un agente líquido que es menos adhesivo y de polimerización lenta) han aumentado la probabilidad de lograr la obliteración.
De esta forma es posible con un riesgo muy bajo de complicaciones isquémicas, ocluir los vasos malformados a través de un microcatéter. Esto puede llevar a la eliminación completa de una MAV constituyéndose en estos casos como un tratamiento definitivo, o bien reduciendo significativamente el volumen del nido malformativo para completar una segunda fase a través de la resección quirúrgica o de radiocirugía (Steiger 2004).
Materiales
Los materiales disponibles son agentes embólicos líquidos adhesivos (Hystoacril, Glubran ®), agentes embólicos no adhesivos (Onyx) y partículas de polivinil alcohol (Loh 2010).
Complicaciones
Las complicaciones posibles tras la embolización endovascular son el infarto cerebral y la hemorragia intracerebral (3 a 15 % por paciente y 1 al 2 % por procedimiento).
La embolización previa a la radiocirugía disminuye la tasa de obliteración (Andrade-Souza, Ramani et al. 2007).
La embolización parcial, puede ser capaz de asegurar la MAV antes del tratamiento definitivo (Krings 2010).
Complicaciones postoperatorias.-
Cambios de la presión de perfusión cerebral por trastorno de la autoregulación aunque esta teoría es discutible.
Hiperemia oclusiva de la vena de drenaje o por trombosis.
Resangrado por resto de nidus de MAV. (Especialmente los profundos).
Epilepsia.
Radiocirugía
El riesgo de hemorragia persiste en el período de latencia después de la radiocirugía, y sigue siendo finito, incluso después de obliteración completa (Sun 2010).
Uno de los factores que podrían contribuir al cierre es el efecto que esta técnica tiene sobre los miofibroblastos (Szeifert, Timperley et al. 2007).
La oclusion histológica precisa más tiempo que la neuroimágen (Tu, Stoodley et al. 2006).
Reduce perceptiblemente el riesgo de la primera hemorragia (Maruyama, Shin et al. 2007).
En cambio en la edad pediátrica su indicación según autores debería ser más restringida debido a la consideración de los efectos secundarios de la radiación a largo plazo (Zadeh, Andrade-Souza et al. 2007), pero otros han tenido resultados superponibles a la de adultos con el mismo esquema de tratamiento (Zabel-du Bois, Milker-Zabel et al. 2006; Reyns, Blond et al. 2007).
La radiocirugía, es decir, la irradiación selectiva con altas dosis de radiación de blancos pequeños estereotácticamente definidos con respeto de las áreas elocuentes vecinas, ha significado un gran aporte al manejo de las MAV, especialmente aquellas de pequeño tamaño localizadas en regiones profundas del cerebro. El rendimiento en malformaciones pequeñas la hacen ser la alternativa de elección además para remanentes posteriores a una embolización en áreas de dificil acceso.
En seguimientos entre 5 a 10 años se han conseguido obliteraciones de un 75 a 90 % para pequeñas MAVs con disminución de la morbilidad debida al tratamiento en MAV de grado Spetzler > de 3.
Complicaciones: Radionecrosis (Nishimura 2010).
La repetición de la radiocirugía es una opción viable para el tratamiento de pequeños remanentes, pero presenta un 20% de complicaciones radioinducidas, cifra conocida en las MAV relativamente grandes, y por lo tanto difíciles de tratar (Buis 2010).
Pronóstico
Las malformaciones arteriovenosas con hemorragia previa, localización profunda, drenaje venoso profundo exclusivo, y aneurismas asociados tienen mayores tasas de hemorragia (Gross y col., 2013).
Las profundas y altamente elocuentes, ubicadas ya sea en el tálamo / ganglios basales o en el tronco cerebral, se comportan más agresivamente que otras malformaciones arteriovenosas.
La localización profunda para ser un factor de riesgo independiente de hemorragia (Kader y col., 1994; Turjman y col., 1995; Khaw y col., 2004; Stapf y col., 2006; Yamada y col., 2007; Hernesniemi y col., 2008; da Costa y col., 2009).
Probablemente uno de los aspectos todavía inciertos en la toma de decisiones de tratamiento en las MAV es una relativa falta de datos acerca de la evolución natural de esta patología, sobre todo en pacientes en edades relativamente avanzadas.
Ha mejorado mucho el diagnóstico y se han desarrollado paralelamente los tratamientos, pero todavía es incierto establecer los riesgos de morbilidad o mortalidad asociados a la simple observación.
El desafío de los próximos años es delimitar exactamente la estrategia de tratamiento para cada paciente en particular basados en el análisis exacto y cuidadoso del balance entre el riesgo de la evolución natural y de la suma de los riesgos de la combinación de modalidades terapéuticas ofrecidas.
El riesgo de sangrado de una MAV es aproximadamente de 2 a 4% anual.
Las MAV pequeñas tienen mayor tendencia al sangrado debido a que puedan tener mayor presión.Pero las grandes son más epileptógenas por la mayor participación cortical.
El riesgo anual de hemorragia cerebral se ha recogido en 3 estudios y depende fundamentalmente de el tamaño de la MAV y de la edad del paciente.
Los resultados de control de las convulsiones post-embolización durante el período de seguimiento promedio de 80 meses fueron excelentes en 21 pacientes, buena en cuatro, regular en dos y pobres en tres (Lv 2010).
Bibliografía
Andrade-Souza, Y. M., M. Ramani, et al. (2007). “Embolization before radiosurgery reduces the obliteration rate of arteriovenous malformations.” Neurosurgery 60(3): 443-51; discussion 451-2.
Buis, Dennis R, Otto W M Meijer, René van den Berg, Frank J Lagerwaard, Joost C J Bot, Ben J Slotman, y W Peter Vandertop. 2010. Clinical outcome after repeated radiosurgery for brain arteriovenous malformations. Radiotherapy and Oncology: Journal of the European Society for Therapeutic Radiology and Oncology 95, no. 2 (Mayo): 250-256. doi:10.1016/j.radonc.2010.03.003.
Challa VR, Moody DM, Brown WR: Vascular malformations of the central nervous system. J Neuropathol Exp Neurol 54: 609–621, 1995
Choi JH, Mohr JP: Brain arteriovenous malformations in adults. Lancet Neurol 4:299–308, 2005.
da Costa L, Wallace MC, ter Brugge KG, O′Kelly C, Willinsky RA, Tymianski M. The natural history and predictive features of hemorrhage from brain arteriovenous malformations. Stroke. 2009;40(1):100–105.
Davidson, Andrew S, y Michael K Morgan. 2010. How safe is arteriovenous malformation surgery? A prospective, observational study of surgery as first-line treatment for brain arteriovenous malformations. Neurosurgery 66, no. 3 (Marzo): 498-504; discussion 504-505. doi:10.1227/01.NEU.0000365518.47684.98.
Feliciano, Caleb E, Ramón de León-Berra, Manuel S Hernández-Gaitán, y Rafael Rodríguez-Mercado. 2010. A proposal for a new arteriovenous malformation grading scale for neuroendovascular procedures and literature review. Puerto Rico Health Sciences Journal 29, no. 2 (Junio): 117-120.
Friedlander RM: Arteriovenous malformations of the brain. N Engl J Med 356:2704–2712, 2007.
Gross, Bradley A, and Rose Du. 2013. “Natural History of Cerebral Arteriovenous Malformations: a Meta-analysis.” Journal of Neurosurgery 118 (2) (February): 437–443. doi:10.3171/2012.10.JNS121280.
Hasan, David M, Matthew Amans, Tarik Tihan, Christopher Hess, Yi Guo, Soonmee Cha, Hua Su, et al. 2012. “Ferumoxytol-enhanced MRI to Image Inflammation Within Human Brain Arteriovenous Malformations: A Pilot Investigation.” Translational Stroke Research 3 (Supplement 1) (July): 166–173. doi:10.1007/s12975-012-0172-y.
Hernesniemi JA, Dashti R, Juvela S, Vaart K, Niemelä M, Laakso A. Natural history of brain arteriovenous malformations: a long-term follow-up study of risk of hemorrhage in 238 patients. Neurosurgery. 2008;63(5):823-831.
Kader A, Young WL, Pile-Spellman J, et al.. The Influence of hemodynamic and anatomic factors on hemorrhage from cerebral arteriovenous malformations. Neurosurgery. 1994;34(5):801–808.
Khaw AV, Mohr JP, Sciacca RR, et al.. Association of infratentorial brain arteriovenous malformations with hemorrhage at initial presentation. Stroke. 2004;35(3):660–663.
Jabbour, Mark N, James B Elder, Christian G Samuelson, Shabnam Khashabi, Florence M Hofman, Steven L Giannotta, y Charles Y Liu. 2009. «Aberrant angiogenic characteristics of human brain arteriovenous malformation endothelial cells». Neurosurgery 64 (1) (Enero): 139-146; discussion 146-148. doi:10.1227/01.NEU.0000334417.56742.24.
Kamiyama, Hironaga, Shinjitsu Nishimura, Mitsuhiro Kaimori, Mika Watanabe, Yuichi Furuno, Atsushi Saito, y Michiharu Nishijima. 2010. Cavernous angioma associated with arteriovenous malformation of the brain–case report. Neurologia Medico-Chirurgica 50, no. 2: 131-134.
Kretzer, Ryan M, Alexander L Coon, y Rafael J Tamargo. 2010. Walter E. Dandy's contributions to vascular neurosurgery. Journal of Neurosurgery 112, no. 6 (Junio): 1182-1191. doi:10.3171/2009.7.JNS09737.
Krings, Timo, Franz-Josef Hans, Sasikhan Geibprasert, y Karel Terbrugge. 2010. Partial “targeted” embolisation of brain arteriovenous malformations. European Radiology (Junio 11). doi:10.1007/s00330-010-1834-3. http://www.ncbi.nlm.nih.gov/pubmed/20535613.
Lawton, Michael T, Helen Kim, Charles E McCulloch, Bahar Mikhak, y William L Young. 2010. A supplementary grading scale for selecting patients with brain arteriovenous malformations for surgery. Neurosurgery 66, no. 4 (Abril): 702-713; discussion 713. doi:10.1227/01.NEU.0000367555.16733.E1.
Loh, Yince, y Gary R Duckwiler. 2010. A prospective, multicenter, randomized trial of the Onyx liquid embolic system and N-butyl cyanoacrylate embolization of cerebral arteriovenous malformations. Journal of Neurosurgery (Abril 30). doi:10.3171/2010.3.JNS09370. http://www.ncbi.nlm.nih.gov/pubmed/20433277.
Lukic, Stevo, Mirjana Spasic, Zoran Peric, Dejan Savic, Slobodan Vojinovic, Dragan Stojanov, y Srdjan Ljubisavljević. 2011. A case of complex arteriovenous malformation with skull destruction presented in sixth decade of life. Neurological Sciences: Official Journal of the Italian Neurological Society and of the Italian Society of Clinical Neurophysiology (Enero 14). doi:10.1007/s10072-010-0472-5. http://www.ncbi.nlm.nih.gov/pubmed/21234773.
Lv, X, Y Li, C Jiiang, X Yang, y Z Wu. 2010. Brain arteriovenous malformations and endovascular treatment: effect on seizures. Interventional Neuroradiology: Journal of Peritherapeutic Neuroradiology, Surgical Procedures and Related Neurosciences 16, no. 1 (Marzo): 39-45.
Maruyama, K., M. Shin, et al. (2007). “Radiosurgery to reduce the risk of first hemorrhage from brain arteriovenous malformations.” Neurosurgery 60(3): 453-8; discussion 458-9.
Nagayama, Kazuki, y Hiroki Kurita. 2010. Symmetrical cerebral arteriovenous malformations in bilateral basal ganglia. Cerebrovascular Diseases (Basel, Switzerland) 29, no. 4: 412. doi:10.1159/000288057.
Neacsu, Angela, y A V Ciurea. 2010. General considerations on posterior fossa arteriovenous malformations (clinics, imaging and therapy). Actual concepts and literature review. Journal of Medicine and Life 3, no. 1 (Marzo): 26-35.
Nishimura, Fumihiko, Yasushi Motoyama, Junichi Ihida, Young-Soo Park, Hidehiro Hirabayashi, Hiroyuki Nakase, Toshisuke Sakaki, Shigenori Minami, y Toshihide Tsuzuki. 2010. [Symptomatic radiation necrosis 10 years after gamma knife surgery for arteriovenous malformations: a case report]. Brain and Nerve = Shinkei Kenkyū No Shinpo 62, no. 5 (Mayo): 539-543.
Onabolu, O O, y T Y Oyebadejo. 2010. Arteriovenous malformation of the occipital lobes in a Nigerian. The Nigerian Postgraduate Medical Journal 17, no. 2 (Junio): 179-182.
Reyns, N., S. Blond, et al. (2007). “Role of radiosurgery in the management of cerebral arteriovenous malformations in the pediatric age group: data from a 100-patient series.” Neurosurgery 60(2): 268-76; discussion 276.
Rutka JT, Apodaca G, Stern R, Rosenblum M: The extracellular matrix of the central and peripheral nervous systems: Structure and function. J Neurosurg 69: 155–170, 1988.
Stapf C, Mast H, Sciacca RR, et al.. Predictors of hemorrhage in patients with untreated brain arteriovenous malformation. Neurology. 2006;66(9):1350–1355.
Steiger, H J, H Brückmann, T Mayer, R Schmid-Elsaesser, y S Zausinger. 2004. Congested residual nidus after preoperative intranidal embolization in midsize cerebral arteriovenous malformations of 3-6 cm in diameter. Acta Neurochirurgica 146, no. 7 (Julio): 649-657. doi:10.1007/s00701-004-0273-9.
Sun, Daniel Q, Kathryn A Carson, Shaan M Raza, Sachin Batra, Lawrence R Kleinberg, Michael Lim, Judy Huang, y Daniele Rigamonti. 2010. The Radiosurgical Treatment of Arteriovenous Malformations: Obliteration, Morbidities, and Performance Status. International Journal of Radiation Oncology, Biology, Physics (Abril 16). doi:10.1016/j.ijrobp.2010.01.049. http://www.ncbi.nlm.nih.gov/pubmed/20400239.
Szeifert, G. T., W. R. Timperley, et al. (2007). “Histopathological Changes in Cerebral Arteriovenous Malformations following Gamma Knife Radiosurgery.” Prog Neurol Surg 20: 212-9.
Tu, J., M. A. Stoodley, et al. (2006). “Responses of arteriovenous malformations to radiosurgery: ultrastructural changes.” Neurosurgery 58(4): 749-58; discussion 749-58.
Turjman F, Massoud TF, Viñuela F, Sayre JW, Guglielmi G, Duckwiler G. Correlation of the angioarchitectural features of cerebral arteriovenous malformations with clinical presentation of hemorrhage. Neurosurgery. 1995;37(5):856–862.
Vates GE, Lawton MT, Wilson CB, et al. Magnetic source imaging demonstrates altered cortical distribution of function in patients with arteriovenous malformations. Neurosurgery. 2002;51(3):614-627.
Vilalta, Jordi, y Fuat Arikán. 2010. [Who controls non-surgical arteriovenous malformations of the brain in Spain?]. Revista De Neurologia 50, no. 8 (Abril 16): 511-512; author reply 512.
Yamada S, Takagi Y, Nozaki K, Kikuta K, Hashimoto N. Risk factors for subsequent hemorrhage in patients with cerebral arteriovenous malformations. J Neurosurg. 2007;107(5):965–972.
Zabel-du Bois, A., S. Milker-Zabel, et al. (2006). “Linac-based radiosurgery or hypofractionated stereotactic radiotherapy in the treatment of large cerebral arteriovenous malformations.” Int J Radiat Oncol Biol Phys 64(4): 1049-54.
Zabel-du Bois, A., S. Milker-Zabel, et al. (2006). “Pediatric cerebral arteriovenous malformations: the role of stereotactic linac-based radiosurgery.” Int J Radiat Oncol Biol Phys 65(4): 1206-11.
Zadeh, G., Y. M. Andrade-Souza, et al. (2007). “Pediatric arteriovenous malformation: University of Toronto experience using stereotactic radiosurgery.” Childs Nerv Syst 23(2): 195-9.