Meningioma
Tumor de las meninges (células meningoteliales), extraaxial, que procede de la transformación de las células aracnoideas de las meninges, especialmente de las vellosidades aracnoideas, adhiriéndose a la duramadre.
La base del tumor infiltra a la duramadre y en ocasiones al hueso adyacente.
Epidemiología
En la mayoría de las series clínicas representan alrededor del 20‐25% de todos los tumores cerebrales primarios, mientras que en las series de autopsia pueden llegar hasta el 30%.
27,1% de lo tumores cerebrales primarios según Shibui 1).
35,5% de los tumores del sistema nervioso, de los cuales el 21-37.8% son atípicos o anaplásico/malignos según Zhou y col.,2).
Son más frecuentes en mujeres, con una relación de 2:1 con respecto a los varones, que se explicaría por la presencia de receptores hormonales para la progesterona en meningiomas.
Aumenta con la edad, y son excepcionales por debajo de los 20 años, y si aparecen suelen ser más agresivos. (Wiemels y col., 2010).
Los meningiomas pediátricos, representan el 0,4% hasta el 4,1% de los tumores en pacientes pediátricos y del 1,5% al 1,8% de todos los meningiomas intracraneales, y está relacionada en un 25% de los casos con la enfermedad de von Recklinghausen.
En un estudio sobre 12 pacientes (nueve hombres y tres mujeres, rango de edad, 4-18 años, con una media, años 12,8), se apreció que los meningiomas atípicos y malignos parecen ser más comunes en la infancia y la adolescencia que en la edad adulta (Jaiswal y col., 2011).
Etiología
Factores citogenéticos
Las segundos anomalías genéticas más frecuentes en meningiomas después de la pérdida de 22q son las deleciones 1p y 14q [(Arslantas, Ali, Sevilhan Artan, Ulkü Oner, Ramazan Durmaz, Hamza Müslümanoğlu, Metin Ant Atasoy, Nurettin Başaran, and Eşref Tel. “Comparative Genomic Hybridization Analysis of Genomic Alterations in Benign, Atypical and Anaplastic Meningiomas.” Acta Neurologica Belgica 102, no. 2 (June 2002): 53–62.)] [(Cai, D X, R Banerjee, B W Scheithauer, C M Lohse, B K Kleinschmidt-Demasters, and A Perry. “Chromosome 1p and 14q FISH Analysis in Clinicopathologic Subsets of Meningioma: Diagnostic and Prognostic Implications.” Journal of Neuropathology and Experimental Neurology 60, no. 6 (June 2001): 628–636.)] [(Hamilton, Brenda O, Joanne S Sy, Joseph F Megyesi, and Lee Cyn Ang. “Her2neu Amplification Associates with Co-deletion 1p/14q in Recurrent Meningiomas.” The Canadian Journal of Neurological Sciences. Le Journal Canadien Des Sciences Neurologiques 40, no. 3 (May 2013): 361–365.)].
La inactivación del gen NF2 en 22q12 se ha identificado como un evento temprano en su patogénesis, mientras que anormalidades en el cromosoma 14 han sido reportados en los meningiomas de alto grado, así como tumores recurrentes.
Desde hace tiempo se supone que el cromosoma 14q32 contiene el gen supresor del tumor, MEG3 que codifica un ARN no codificante (ncRNA).
La incidencia de monosomía 22/22q– y monosomía 14/14q– oscila entre el 31 y el 78%, entre el 12 y el 27% de los casos, respectivamente, dependiendo de las series analizadas.
Aunque no se conoce con precisión las causas de esta variabilidad, se cree que puede obedecer a cuestiones metodológicas, como el tipo de técnica citogenética utilizada, los criterios empleados para definir la existencia de anomalías de los cromosomas 22 y 14 y el pequeño número de pacientes analizados en una importante proporción de estos trabajos [(http://www.elsevier.es/sites/default/files/elsevier/pdf/2/2v128n06a13098721pdf001.pdf)].
La pérdida de expresión MEG3 y el grado de metilación del promotor se han asociado con el crecimiento tumoral agresivo. Estos hallazgos indican que el MEG3 puede tener un papel importante como un supresor tumoral en meningiomas (Balik y col., 2013).
Factores celulares
Tales como la activación de la telomerasa y las mutaciones del receptor tirosina quinasa, también pueden desempeñar un papel importante.
Factores autocrinos
Finalmente, los factores autocrinos y paracrinos incluyendo receptor del factor de crecimiento derivado del factor-1 de crecimiento de plaquetas ,y el factor de crecimiento fibroblásticode han sido implicados en el desarrollo de algunos tumores.
Aunque la relación entre los diversos factores implicados en el desarrollo del tumor es desconocida, la comprensión de estos factores será crítico en el tratamiento de meningiomas malignos o inaccesibles quirúrgicamente.
Los resultados indican la importancia de una historia familiar positiva de meningioma y sugieren que los individuos con familiares de primer grado diagnosticados a una edad temprana corren un riesgo aún mayor (Claus y col., 2011).
La exposición a altas dosis de radiación ionizante es un factor de riesgo.
Las dosis más bajas también pueden aumentar el riesgo, pero los tipos y las dosis son controvertidos o poco estudiados.
Las mujeres tienen el doble de probabilidades que los hombres de desarrollar meningiomas justificado ya que estos tumores tienen receptores hormonales.
La medida en que los factores inmunológicos influencian es un asunto inexplorado (Wiemels y col., 2010).
Se precisa un examen más detallado de estos factores por separado, así como la forma de las interacciones gen-ambiente.
Clasificación
Clasificaremos a los meningiomas según su localización y tipo histológico:
Localización
Tipo histológico
Meningioma (WHO 3)
Alrededor del 90% de los meningiomas son benignos (grado I de la OMS).
Las variantes atípicas y anaplásicas existen (OMS grado II / III) en un 10%.
Según la edad
Meningioma en el anciano los cuales según autores tienen o son mayores de 65 años (Wofford y col., 1993; Black y col., 1998; Schul y col., 2011) o igual o mayores de 70 años (Umansky y col., 1992; Proust y col., 1997; Buhl y col., 2000; Tucha y col., 2001; Bateman y col., 2005).
Diagnóstico
TAC
En TAC son lesiones muy bien delimitadas y suele mostrar una lesión hiperdensa tras administración de contraste que puede estar rodeado de edema y de base de implantación amplia.
Es la modalidad que mejor muestra las calcificaciones tumorales. Éstas pueden ser nodulares, puntiformes o densas.
La TC es muy efectiva en la demostración de la hiperostosis (15-20%), osteolisis y erosión en el sitio de la inserción dural.
RM
La prueba diagnóstica de elección es la RM:
Una ventaja importante de la resonancia en los meningiomas es su resolución superior de los distintos tipos de tejidos, y su capacidad multiplanar que es el mejor medio de visualizar el contacto del tumor con las meninges. También puede demostrar la vascularización y la diseminación vía LCR. En T1 la mayoría de los meningiomas son isointensos respecto a la sustancia gris; en T2, son hiperintensos. Refuerzo intenso en el 85% de los tumores.
La apariencia en anillo puede representar una cápsula, pero también un aumento de tejido fibroconectivo con proliferación de vasos dilatados en la periferia del tumor (Yuan y col., 2012).
Las imágenes ponderadas en T2 muestran bien la extensión del edema.
Pueden presentar el signo de la cola dural.
Los distintos subtipos histológicos pueden tener diferentes apariencias en la RM. La señal en T2 se correlaciona mejor con la histología y la consistencia del meningioma. Generalmente, porciones del tumor de baja intensidad de señal en T2 indican componentes más fibrosos y rígidos, mientras que las áreas de alta intensidad indican tejidos más blandos o microhipervascularidad, características más frecuentes en los tumores agresivos. Falsos negativos: la RM no es confiable en la demostración de calcificación tumoral. En secuencias convencionales una hemorragia aguda intratumoral puede generar una señal mixta. Sin contraste, los meningiomas en placa pueden ser difíciles de detectar.
RM espectroscópica
Aumento de colina
Disminución de NAA
Ocasionalmente presente:Alanina
Angiografía cerebral
Es muy útil para conocer la vascularización del meningioma.
Suele tener un patrón radial central “cabeza de medusa”.
Ocasionalmente se precisará una angiografía cerebral para planificar una intervención o una embolización y para determinar si existe permeabilidad de los senos venosos. La angiografía es útil para delinear si el suministro vascular es de la carótida externa o interna, y puede mostrar atrapamientos de los vasos intracraneales. Muestra el mapa arterial necesario para la embolización prequirúrgica.
El grueso de la lesión se ilumina tras la inyección de la carótida externa, mientras que la capa más superficial o externa se rellena tras la inyección de la carótida interna.Las arterias meníngeas penetran en el tumor a través de su inserción dural y se distribuyen radialmente, en “rayos de sol”. La tinción homogénea y nítida del tumor se ve en forma precoz y permanece tardíamente. Usualmente los meningiomas no presentan venas de drenaje.
En los meningiomas frontobasales la irrigación proceder de ramas de la arteria etmoidal que es a su vez rama de la arteria oftálmica.
Tratamiento
El tratamiento quirúrgico sigue siendo el tratamiento preferido y en algunos casos es precedida por la embolización.
La radiocirugía estereotáctica y la radioterapia se están utilizando cada vez más sobre todo en los inaccesibles, recurrentes, o extirpados de forma subtotal, particularmente si son malignos o anaplásicos.
En algunos pacientes la decisión terapéutica puede ser difícil debido a la falta de síntomas o los riesgos de la intervención, pero la extirpación quirúrgica de un meningioma en el anciano es un procedimiento seguro si la clasificación ASA es I o II y, si el Karnofsky es por lo menos 70, por lo que la edad no parece ser un obstáculo insuperable 3).
Cirugía
El manejo de los meningiomas está descrito en las obras clásicas de Cushing and Eisenhardt . Meningiomas edited by Al-Mefty and Meningiomas and Their Surgical Management edited by Schmidek, 1991.
Los aspectos claves son:
Colocación del paciente y planificación correcta de la incisión.
Interrupción temprana de las arterias.
Decomprensión interna
Disección del la cápsula del tumor extirpando la duramadre y hueso afectados.
Reconstrucción de los defectos durales.
El objetivo del tratamiento es la extirpación completa, junto con la duramadre afectada que sirve de base de implantación, para evitar las recidivas. Se utilizan tecnologías para facilitar su extirpación (microcirugía, aspirador ultrasónico, coagulación bipolar). En numerosas ocasiones se procede a la embolización preoperatoria de las ramas meníngeas, lo que permite una manipulación quirúrgica más exangue y con mejor visión de los planos y estructuras a respetar.Pero todo ello puede acarrear morbilidad importante sobre todo en los de seno cavernoso, región petroclival, parte posterior del seno longitudinal,vaina del nervio óptico,esfeno-orbitarios y en placa. Su extirpación puede causar lesión vascular y neuropatías severas.
En los fuertemente adheridos a senos venosos se prefiere la resección subtotal preservando la integridad vascular y neurológica y tratar el tumor residual con radiación o seguimiento por imágen.
Grado de extirpación según Simpson:
1 extirpación total del tumor y de la dura así como del si éste estuviera infiltrado
2 extirpación total del tumor y coagulación de la dura.
3 extirpación total del tumor sin coagulación de la dura.
4 resección parcial
5 descompresión o biopsia.
Para prevenir el infarto venoso, es esencial mantener el plano aracnoideo , lo que es especialmente importante en los meningiomas de más de 4 cm, con edema peritumoral o superficiales cerca de la línea media del seno venoso (Jang y col., 2012).
Medicamentos
Administración de esteroides por lo menos dos días antes de la intervención y reducción en el postoperatorio de esteroides dependiendo del edema cerebral.
10-20 mg de furosemida y 100 g de manitol durante la exposición.
Radioterapia
La radioterapia ha demostrado que es capaz de frenar el crecimiento de algunos meningiomas . Las indicaciones quedan reducidas a aquellas que no se pueden tratar mediante cirugía, resecciones incompletas, recurrentes y los meningiomas atípicos o anaplásicos.
Sin embargo no existe ningún estudio prospectivo, randomizado y pocos tienen un periodo de seguimiento lo suficientemente largo para sacar conclusiones de eficacia e incidencia de complicaciones tardías.
La dosis total es de 5000-5500 cGy en fracciones diarias de 180-200 cGY durante 5-6 semanas ). La tasa de complicaciones es baja si se tiene un cuidado especial con el nervio óptico y el mesencéfalo.
Radiocirugía con cobalto
La radiocirugía estereotáctica, se utiliza cada vez más para tratar estas lesiones.
En aquellos casos (por lo general meningiomas de base de cráneo) en los que se han de dejar restos tumorales pequeños (menores de 3 cms.), para respetar estructuras importantes (pares craneales, por ejemplo), está cada vez más indicada la utilización de técnicas de radiocirugía. Se aplica una dosis única de entre quince a dieciocho Gy. El acelerador lineal también es efectivo en el tratamiento de los meningiomas una dosis en los márgenes el tumor de 1500 rad es adecuado para el control del tumor. también existe experiencia con la irradiación protónica.
Sólo si la exéresis no es total o en casos con meningiomas anaplásicos, se puede indicar la radioterapia como tratamiento complementario al quirúrgico.
Observación
No todos los pacientes con un meningioma necesitan una intervención quirúrgica.
En algunos pacientes basta con un control periódico clínico y de resonancia nuclear magnética.
Las indicaciones para un tratamiento conservador son pacientes con mínimo edema cerebral, mínimos síntomas y una larga anamnesis o pacientes muy mayores y síntomas progresivos mínimos. Asimismo aquellos pacientes en los cuales un tratamiento quirúrgico sea muy arriesgado.
Pronóstico
Los meningiomas tratados con resección subtotal o parcial se asocian con un número significativamente menor supervivencia libre de recurrencia que aquellos tratados con resección macroscópica total.
En líneas generales un meningioma no recidiva si se ha conseguido extirpar su base de implantación. De forma global, no obstante, hay que considerar unos porcentajes de recidiva de un 9 % a los 5 años. Este porcentaje de recurrencias asciende a casi el 40% cuando la extirpación no es total.
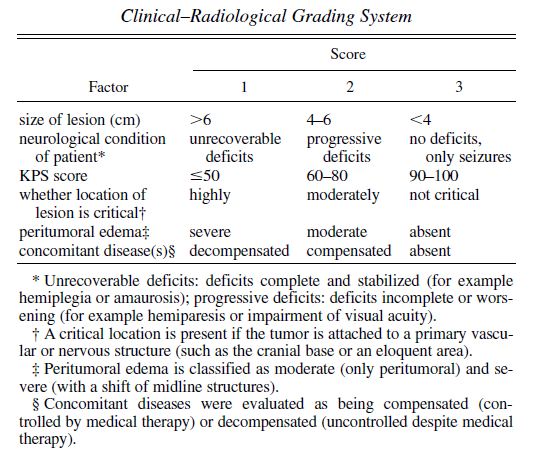
CRGS
Fuente: (Caroli y col., 2005).
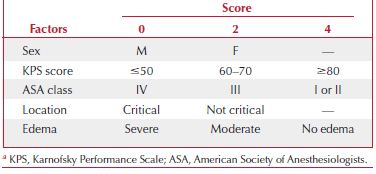
SKALE
(Sacko y col., 2007).
Según Schul y col.,estos dos sistemas predictivos tienen un valor limitado para predecir la mortalidad en pacientes de edad avanzada. Opinan que el mejor enfoque es el juicio cuidadoso de su estado de salud general (Schul y col., 2011).
The Geriatric Scoring System (GSS) (Cohen-Inbar y col., 2011).
La hipoxia tumoral en meningiomas está asociada con un fenotipo agresivo, aunque se requieren más estudios para definir la contribución de la hipoxia a la fisiopatología del meningioma.
Bibliografía
Bateman, B.T. et al., 2005. Meningioma resection in the elderly: nationwide inpatient sample, 1998-2002. Neurosurgery, 57(5), págs.866-872; discussion 866-872.
Black, P., Kathiresan, S. & Chung, W., 1998. Meningioma surgery in the elderly: a case-control study assessing morbidity and mortality. Acta Neurochirurgica, 140(10), págs.1013-1016; discussion 1016-1017.
Buhl, R. et al., 2000. Results in the operative treatment of elderly patients with intracranial meningioma. Neurosurgical Review, 23(1), págs.25-29.
Caroli, M. et al., 2005. Surgery for intracranial meningiomas in the elderly: a clinical-radiological grading system as a predictor of outcome. Journal of Neurosurgery, 102(2), págs.290-294.
Claus, Elizabeth B., Lisa Calvocoressi, Melissa L. Bondy, Joellen M. Schildkraut, Joseph L. Wiemels, and Margaret Wrensch. 2011. “Family and personal medical history and risk of meningioma.” Journal of Neurosurgery 115 (6) (December): 1072-1077. doi:10.3171/2011.6.JNS11129.
Cohen-Inbar, O. et al., 2011. The Geriatric Scoring System (GSS) in meningioma patients–validation. Acta Neurochirurgica, 153(7), págs.1501-1508; discussion 1508.
D’Andrea, Giancarlo, Raffaelino Roperto, Emanuela Caroli, Francesco Crispo, and Luigi Ferrante. 2005. “Thirty-seven cases of intracranial meningiomas in the ninth decade of life: our experience and review of the literature.” Neurosurgery 56 (5) (May): 956-961; discussion 956-961.
Jaiswal, Sushila, Mukul Vij, Anant Mehrotra, Awadhesh Kumar Jaiswal, Arun Kumar Srivastava, and Sanjay Behari. 2011. “A Clinicopathological and Neuroradiological Study of Paediatric Meningioma from a Single Centre.” Journal of Clinical Neuroscience: Official Journal of the Neurosurgical Society of Australasia 18 (8) (August): 1084–1089. doi:10.1016/j.jocn.2010.11.036.
Jang, Woo-Youl, Shin Jung, Tae-Young Jung, Kyung-Sub Moon, and In-Young Kim. 2012. “Predictive Factors Related to Symptomatic Venous Infarction After Meningioma Surgery.” British Journal of Neurosurgery 26 (5) (October): 705–709. doi:10.3109/02688697.2012.690914.
Proust, F. et al., 1997. [Intracranial meningioma in the elderly. Postoperative mortality, morbidity and quality of life in a series of 39 patients over 70 years of age]. Neuro-Chirurgie, 43(1), págs.15-20.
Rohringer M, Sutherland GR, Louw DF, Sima AAF: Incidence and clinicopathological features of meningioma. J Neurosurg 71:665–672, 1989
Sacko O, Sesay M, Roux F-E, et al. Intracranial meningioma surgery in the ninth decade of life. Neurosurgery. 2007;61(5):950-954; discussion 955.
Schul, D.B. et al., 2011. Meningioma surgery in the elderly: Outcome and validation of two proposed grading scores systems. Neurosurgery. Available at: http://www.ncbi.nlm.nih.gov/pubmed/21866064
Tucha, O., Smely, C. & Lange, K.W., 2001. Effects of surgery on cognitive functioning of elderly patients with intracranial meningioma. British Journal of Neurosurgery, 15(2), págs.184-188.
Umansky, F. et al., 1992. Surgical outcome in an elderly population with intracranial meningioma. Journal of Neurology, Neurosurgery, and Psychiatry, 55(6), págs.481-485.
Wiemels, J., Wrensch, M. & Claus, E.B., 2010. Epidemiology and etiology of meningioma. Journal of Neuro-Oncology, 99(3), págs.307-314.
Wofford, J.L. et al., 1993. Clinical presentation of meningioma in the elderly. Journal of the American Geriatrics Society, 41(2), págs.122-126.
Yuan, Yu-Qing, Min Hou, Hong Wu, and Fan Wang. 2012. “A Meningioma with Peripheral Rim Enhancement on MRI.” Brain Tumor Pathology (February 3). doi:10.1007/s10014-012-0082-4. http://www.ncbi.nlm.nih.gov/pubmed/22302538.