Meningioma de la convexidad
Meningioma intracraneal que crece hacia la superficie del cerebro directamente debajo del cráneo.
Epidemiología
El meningioma de la convexidad es el meningioma intracraneal mas frecuente (22%) 1).
Puede surgir de cualquier área de la duramadre sobre la convexidad, pero son más comunes a lo largo de la sutura coronal y cerca de la región parasagital.
Clasificación
Liu et al. introduce una clasificación radiológica preoperatoria para predecir el comportamiento radiológico y clínico agresivo del meningioma de convexidad.
Grupo I 0–1 puntos
Grupo II 2–3 puntos
Grupo III 4–5 puntos
El meningioma del grupo I demostró un comportamiento radiológico, histopatológico y clínico benigno; El grupo III demostró comportamiento radiológico, histopatológico y clínico agresivo. El meningioma del grupo II podría considerarse intermedio ya que algunos tumores histopatológicamente benignos pertenecían al grupo II.
Señales de agresividad:
Señal hiperintensa en difusión por resonancia magnética.
Captación heterogénea en secuencia T1 con Gadolinio.
Capa de aracnoides desaparecida / desintegrada en secuencia T2.
Presencia de edema peritumoral en secuencia T2.
Forma del tumor irregular 2)
Clínica
Puede no causar síntomas hasta que el tumor se ha hecho bastante grande, y cuando lo hace suele estar relacionado con su localización cerebral.
Diagnóstico
Resonancia
Aunque se pueden visualizar por TAC, la RM es la prueba de elección.
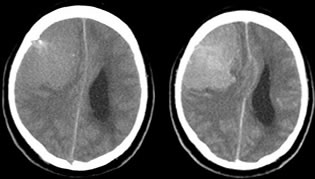
En este TAC sin y con contraste se aprecia una gran masa hiperdensa en la región frontoparietal derecha midiendo 7,2 cm X 4.9cm (axial) con efecto de masa significativo que borra el ventrículo lateral ipsilateral con mínima dilatación del ventrículo lateral contralateral. Desviación de la línea media de 12 mm a la izquierda. Pequeña área de la calcificación. Pequeña área de erosión por presión adyacente. Sin hiperostosis adyacente.
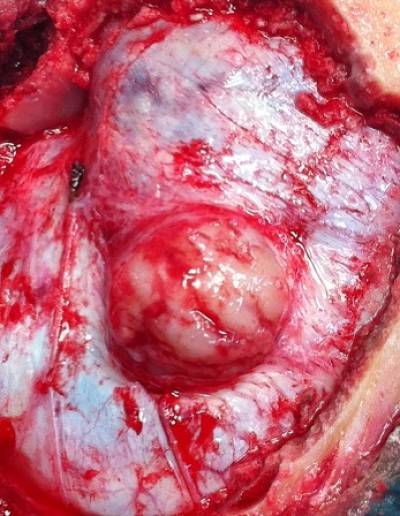
Mostrará una superficie relativamente plana, en continuidad con la duramadre y aparentemente adherida a la superficie interna del hueso.
La superficie interna, en contacto con el cerebro, va a ser convexa, debido a la tendencia tumoral a crecer de manera esférica.
Puede mostrar un importante edema cerebral focal y signo de la cola dural.
Captan contraste y destacan mas que el parénquima cerebral.
La RM espectroscópica y la RM Funcional, pueden utilizarse para obtener mayor información, del tipo de tumor o de la función de la corteza cerebral adyacente, respectivamente.
Se puede completar el estudio con una angiografía, que además permite embolizar las arterias nutrientes facilitando así el acto quirúrgico.
Pronóstico
Recurrencia
Por su localización, en la duramadre que se sitúa por debajo de la bóveda craneal, son los más accesibles quirúrgicamente y son los tumores en los que, por regla general, puede realizarse una extirpación más radical. Tienen, por tanto, una mayor posibilidad de curación completa.
Va a depender en gran medida del tipo histológico y la invasión pial, dado que en la serie de Alvernia y col., la tasa de recurrencia de los grados OMS I fue mayor entre aquellos con un plano de disección subpial que entre aquellos con un extrapial. Además el tipo histológico no determinó el grado de invasión pial de los grados OMS I y II (Alvernia y col., 2011).
En la series de Almeida et al. tienen la mitad de riesgo de recurrencia en comaración con otras localizaciones (odds ratio 0.4 [95% CI 0.27 to 0.67], P-value = 0.0002) 3).
En la serie de 163 casos de Morokoff y col., operados entre 1986 y 2005. La mediana del tiempo de seguimiento fue de 2,3 años (rango, 1-13 años) y representaron el 22% de todos los meningiomas operados. Hubo una relación mujer: varón de 2,7:1. La mediana de edad fue de 57 años (rango, 20-89 años). La cirugía guiada por imágenes se utilizó en todos los casos en los últimos 5 años y la tasa de mortalidad a 30 días fue del 0%. La incidencia de nuevos déficits neurológicos fue del 1,7%, y la tasa global de complicaciones fue del 9,4%. La patología de los tumores fue benigna en 144 (88,3%), atípica en 16 (9,8%) y anaplásico / maligno en 3 (1,8%). En seis de los casos designados como “benignos”, había dudosos características atípicas. La tasa de recurrencia a 5 años para los meningiomas benignos fue de 1,8%, meningiomas atípicos 27,2% y anaplásicos 50 %. Los autores concluyen que es necesario un mayor plazo de seguimiento para determinar con precisión las tasas de recurrencia de meningiomas benignos 4).
La posibilidad de que las membranas aracnoideas gruesas y contiguas, pueden relacionarse con la recurrencia (Kamitani y col., 2001).
Kinjo y col introducen el concepto de grado de resección 0 en el que se reseca un margen adicional dural de 2 cm y cree tras los resultados obtenidos que esto puede eliminar células tumorales que se albergan en la cercanía del tumor (Kinjo y col., 1993>).
Epilepsia
Se cree que el uso rutinario de antiepilépticos profilácticos podría prevenir las convulsiones, pero la tasa de nuevas crisis en pacientes no tratados es probablemente muy baja, por lo que se cuestiona que el costo y los efectos secundarios de estos medicamentos justifiquen su administración (Sughrue y col., 2011).
Tratamiento
Extirpación microquirúrgica.
El grado Simpson 1 de resección es el objetivo del tratamiento de los meningiomas de convexidad (Hasseleid y col., 2012).
Sólo en casos muy excepcionales, por mal estado general del paciente o por expreso deseo de éste, puede indicarse tratamiento con radiocirugía, si el tamaño es menor de 3 cm. de diámetro.
La craneotomía ha de hacerse de manera que sobrepase los límites tumorales, para conseguir extirpar el tumor y 1-2 cm. de duramadre alrededor del tumor.
Al seccionar la duramadre, vamos cortando el aporte vascular al tumor. De manera que, al terminar la sección de la duramadre el tumor queda prácticamente exangüe. Con duramadre incluida, se va disecando y separando el meningioma de la corteza cerebral, respetándola al máximo.
Radiocirugía
En una serie de 125 casos con un volumen tumoral medio de 7,6 ml se administró una dosis media de 14,2 Gy.
La tasa de control del tumor fue del 92% y tras la radiocirugía adyuvante, la tasa de control era del 97% para los tumores de grado I. Ningún paciente desarrolló un tumor radioinducido. La morbilidad global fue del 9,6%.
Síntomas con cambios de imagen peritumorales compatibles con edema o efectos adversos a la radiación se presentó en el 5% de los casos, con una media de 8 meses (Kondziolka y col., 2009).
Meningioma de convexidad parietal
Meningioma de convexidad frontal
Clínica.-
Los tumores meníngeos frontales se asocian más a menudo con trastornos psiquiátricos, que pueden retrasar el diagnóstico.
Otras características clínicas son los trastornos de memoria, concentración, personalidad y orientación. Tardan en producir hipertensión intracraneal y el papiledema es tardío.
Diagnóstico.-
Si el meningioma es de la convexidad del cerebro suele acompañarse de un hueso hiperostósico
En el postoperatorio suelen mejorar las funciones de atención y memoria.
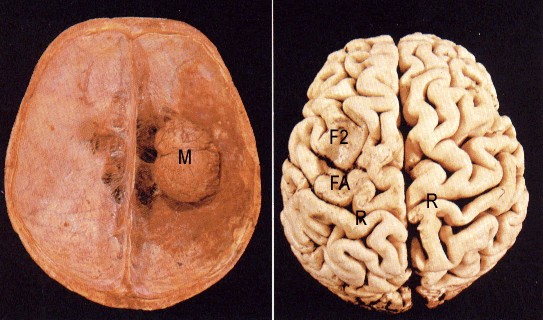
Este meningioma de la convexidad (M) atrofió por presión a la segunda circunvolución frontal izquierda (F2) y precentral o frontal ascendente (FA).( R- Cisura de Rolando)
Caso clínico.-
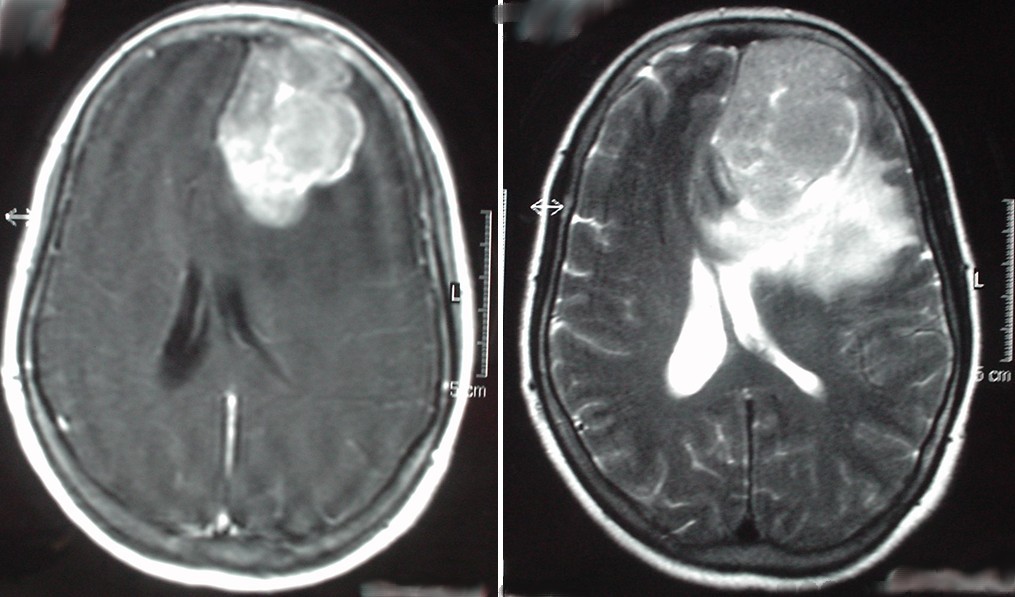
Paciente de 52 años, antecedentes de histerectomía hace 5 años. Cefaleas de larga evolución exacerbadas en las 2 últimas semanas previas a su ingreso con trastornos de conducta y vómitos de repetición, así como cierta alteración y dificultad para hablar. Somnolienta. Afasia motora. Edema papilar bilateral en el fondo de ojo. No focalidad motora. TAC cerebral: Lesion isodensa frontal izquierda que desplaza estructuras de la linea media y edema peritumoral fronto parietal izquierdo.
RMN encefálica: masa extraaxial en polo frontal anterior izquierdo de 5x5x4 cm hipointenso en T1,hiperintenso en T2, realzándose de forma intensa tras administración de contraste.Moderado edema vasogénico.Importante efecto masa sobre la hoz del cerebro y sistema ventricular.
Bibliografía
Alvernia, Jorge E, Nguyen D Dang, and Marc P Sindou. 2011. “Convexity Meningiomas: Study of Recurrence Factors with Special Emphasis on the Cleavage Plane in a Series of 100 Consecutive Patients.” Journal of Neurosurgery 115 (3) (September): 491–498. doi:10.3171/2011.4.JNS101922.
Hasseleid, Bernt Filip, Torstein R Meling, Pål Rønning, David Scheie, and Eirik Helseth. 2012. “Surgery for Convexity Meningioma: Simpson Grade I Resection as the Goal.” Journal of Neurosurgery 117 (6) (December): 999–1006. doi:10.3171/2012.9.JNS12294.
Kamitani, H, H Masuzawa, I Kanazawa, and T Kubo. 2001. “Recurrence of Convexity Meningiomas: Tumor Cells in the Arachnoid Membrane.” Surgical Neurology 56 (4) (October): 228–235.
Kinjo, T, O al-Mefty, and I Kanaan. 1993. “Grade Zero Removal of Supratentorial Convexity Meningiomas.” Neurosurgery 33 (3) (September): 394–399; discussion 399.
Kondziolka, Douglas, Ricky Madhok, L Dade Lunsford, David Mathieu, Juan J Martin, Ajay Niranjan, and John C Flickinger. 2009. “Stereotactic Radiosurgery for Convexity Meningiomas.” Journal of Neurosurgery 111 (3) (September): 458–463. doi:10.3171/2008.8.JNS17650.
Sughrue, Michael E, Martin J Rutkowski, Edward F Chang, Gopal Shangari, Ari J Kane, Michael W McDermott, Mitchel S Berger, and Andrew T Parsa. 2011. “Postoperative Seizures Following the Resection of Convexity Meningiomas: Are Prophylactic Anticonvulsants Indicated? Clinical Article.” Journal of Neurosurgery 114 (3) (March): 705–709. doi:10.3171/2010.5.JNS091972.