Metástasis cerebral por cáncer de mama
Epidemiología
El cáncer de mama es el cáncer más común en las mujeres.
20-30 % de pacientes con cáncer de mama desarrollarán metástasis cerebral.
Es la segunda causa de metástasis cerebrales, siendo la complicación más grave del cáncer de mama y que se produce en un 20% de los casos aproximadamente.
Su incidencia está aumentando, debido en parte a las mejoras terapéuticas que alteran la historia natural del cáncer de mama (Pelletier y col., 2008; Gachet y col., 2011).
La afectación ganglionar con EGFR, p63, y Ki67 alta presentan mayor riesgo de metástasis cerebrales.
Predictores
Entre los diferentes sub-tipos moleculares de cáncer de mama, los tumores HER2 positivos y tumores triple negativos presentan la mayor incidencia de metástasis en el cerebro (Diéras y col., 2011).
La asociación de metástasis en el SNC con sobreexpresión de Epidermal Growth Factor Receptor 2 (HER2) merece especial atención porque se correlaciona con la disminución de intervalo libre de enfermedad y la supervivencia global, y es el factor predictor más importante para predecir la metástasis cerebral.
c-myc
HOXB9
La Heparanasa (HPSE) es una enzima poderosa protumorogénica, proangiogénica, y prometastatic que está sobreexpresada
Tipos
Subtipos
Luminal A, luminal B, HER2 overexpressing, normal-like and basal-like.
La clase triple negativo (receptor de estrógeno negativo, receptor de progesterona negativo y el receptor de factor de crecimiento epidérmico 2 [HER2]-negativo) comprende alrededor del 15% de los canceres de mama. Se asocia con un mal pronóstico en comparación con los tumores que son positivos para receptores hormonales o HER2.
La expresión de antígenos comúnmente asociado con carcinoma de mama no difiere significativamente entre el tumor primario y las metástasis cerebrales correspondientes (Brogi y col., 2011).
Oncogenes
Bmi-1 promueve la invasión y la metástasis del cáncer de mama humanos y predice la supervivencia.
Etiopatogenia
El proceso es complejo y depende de la evasión exitosa de células cancerígenas del tumor primario, la supervivencia en el torrente sanguíneo, microvasculatura cerebral, la penetración de la barrera hematoencefálica y la proliferación en el microambiente cerebral.
Su estudio tras el fracaso en estudios in-vitro dependerá de los análisis in vivo (Lorger y col., 2011).
Diagnóstico
La RM es la modalidad más sensible para la detección de lesiones infraclinicas.
El estudio RM convencional, con difusión, perfusión y espectroscopia tiene un valor diagnóstico con una especificidad de más del 95% (Gerber y col., 2011).
Pronóstico
El pronóstico sigue siendo pobre con una supervivencia media inferior a 1 año, excepto en las lesiones solitarias tratadas mediante cirugía o radiocirugía.
La media de supervivencia es de 1 mes y 4 meses en pacientes sin tratamiento y a 6 meses en pacientes tratados, pero puede ser impredecible en un número considerable de pacientes debido e la heterogeneidad en esta enfermedad (Phillips y col., 1995).
Despende del estado funcional, la edad, la enfermedad y la presencia de metástasis extracraneales, el tipo de tumor primario.
Otros factores, tales como el número, tamaño o ubicación de las metástasis, la histología y el tiempo entre diagnóstico del tumor primario y la detección de la enfermedad a nivel cerebral han sido poco considerados (Villà y col., 2011).
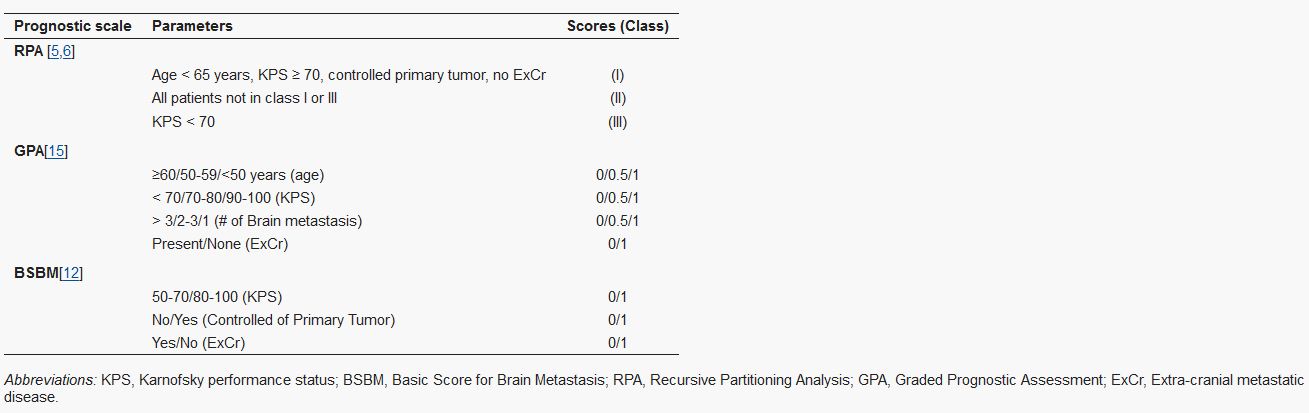
Índice pronóstico
Existen diversas, las más utilizadas son:
Recursive Partitioning Analysis (RPA) prognostic index
Score Index for Radiosurgery (SIR)
Basic Score for Brain Metastases (BSBM)
(Villà y col., 2011).
Complicaciones
Metástasis leptomeníngeas
Son muy frecuentes en cáncer de mama y especialmente marcada en los casos de la sobreexpresión de HER2.
El diagnóstico se basa en los síntomas neurológicos, los estudios de imagen y detección citológica de las células malignas en el líquido cefalorraquídeo (LCR). Sin embargo, a menudo, no son lo suficientemente sensibles (Dono y col., 2011).
Tratamiento
Cirugía
La resección quirúrgica sigue siendo el tratamieto principal de las metástasis cerebrales mayores de 3 cm.
Radiocirugía
El volumen tumoral es un mejor indicador que el diámetro máximo.
El volumen tumoral y el edema respondieron mejor en los pacientes que se sometieron a Radiocirugía estereotáctica
Tratamiento coadyuvante
Para desarrollar nuevos tratamientos, es imprescindible abordar los factores subyacentes a la tumorogénesis, invasión y metástasis
Triple negativo
A pesar de ser sensibles a la quimioterapia, muchas mujeres con cáncer metastásico de mama triple negativo (TNBC) recidiva con rapidez, y comúnmente desarrollan metástasis viscerales, incluidos los de pulmón, el hígado y la metástasis cerebral a pesar de la quimioterapia.
Además, los tumores con el fenotipo triple negativo tienen características específicas y marcadores los cualese son potenciales dianas terapéuticas (Rakha y Chan. 2011).
HER-2 positivo
Las metástasis cerebrales se producen en un tercio de las mujeres con cáncer de mama HER-2 positivo; sin embargo, apenas hay tratamientos para abordarlas.
Tienen una incidencia significativamente mayor de metástasis tras el tratamiento con trastuzumab. Las mejoras en el control sistémico y la supervivencia global asociada al tratamiento con trastuzumab, puede conducir a un “desenmascaramiento” de recurrencia de la enfermedad en el SNC que de otro modo seguiría siendo clínicamente silente (Musolino y col., 2011).
La administración de trastuzumab intratecal debería ser evaluado de forma prospectiva para confirmar la actividad clínica y optimizar la dosis, horario y duración del tratamiento (Oliveira y col., 2011).
En este escenario, el más joven los fármacos aprobados por la Agencia Estadounidense del Medicamento para el tratamiento del cáncer de mama HER-2 positivo avanzado, lapatinib —comercializado como Tyverb por GlaxoSmithKline—, arroja algo de luz.
Según los resultados de un estudio en fase II presentado en la 43ª Reunión Anual de la Sociedad Americana de Oncología Médica (ASCO), lapatinib, administrado como agente único, es eficaz en pacientes con metástasis del sistema nervioso central procedente de un cáncer de mama HER-2 positivo tratadas previamente.
“Se necesitan alternativas terapéuticas eficaces tanto para la prevención como para el tratamiento de metástasis cerebrales procedentes de cáncer de mama”, indicó Nancy U. Lin, del Departamento de Oncología Médica de la Universidad de Harvard e investigadora principal del ensayo.
Así, de las 241 pacientes con lesiones cerebrales previamente tratadas con trastuzumab y radioterapia craneal a las que se les suministró lapatinib en monoterapia, 19 (el 7 por ciento) experimentaron una reducción del tamaño de las lesiones cerebrales igual o mayor al 50 por ciento.
Mientras, 46 (19 por ciento) tuvieron una reducción mínima del 20 por ciento, 102 (42 por ciento) se mantuvieron estables durante al menos ocho semanas y el 22 por ciento no sufrió progresión de la enfermedad en los primeros seis meses de tratamiento. “Estos datos sugieren que lapatinib podría saltar la comprometida barrera hematoencefálica y ser eficaz en el sistema nervioso central”, matizó Lin.
Por otra parte, en Chicago se presentaron los resultados de lapatinib administrado en combinación con el quimioterápico paclitaxel en 580 pacientes con cáncer de mama metastásico de pronóstico negativo. La combinación prolongó la supervivencia libre de progresión en las pacientes con tumores que sobreexpresaban el receptor HER-2. No así en pacientes con tumores HER-2 negativos, donde no aportó ningún beneficio adicional. Con todo, la supervivencia media libre de progresión fue de 7,9 meses con la combinación del antitumoral y el quimioterápico, frente a los 5,2 meses obtenidos con paclitaxel solo. El 60 por ciento de las tratadas con la combinación obtuvo una respuesta parcial o completa, frente al 36 por ciento que lo logró con paclitaxel. En cuanto a los datos de supervivencia general, aún no son definitivos, pero se espera que sean de mejora.
En lo que respecta a los efectos adversos detectados con la combinación de ambos fármacos, son diarrea, erupción cutánea, náuseas, vómitos, neutropenia y mucositis, con un aumento de las dos primeras respecto a la administración del quimioterápico solo (Dawodd y col., 2010).
Trastuzumab
En casos de diseminación leptomeníngea la administración intratecal comenzará muy pronto en un ensayo clínico multicéntrico I-II en el cual el Instituto Curie es el investigador (Gutierrez y col., 2011).
Radioterapia
Muchos pacientes con metástasis cerebrales reciben radioterapia holocraneal con 10 × 3 Gy en 2 semanas como tratamiento estándar en la mayoría de centros (Rades y col., 2011).
Bibliografía
Brogi, E, C G Murphy, M L Johnson, A K Conlin, M Hsu, S Patil, M Akram, et al. 2011. Breast carcinoma with brain metastases: clinical analysis and immunoprofile on tissue microarrays. Annals of Oncology: Official Journal of the European Society for Medical Oncology / ESMO (Marzo 21). doi:10.1093/annonc/mdr022. http://www.ncbi.nlm.nih.gov/pubmed/21427063.
Dawood, Shaheenah, Ana M Gonzalez-Angulo, Constance Albarracin, Tse Kuan Yu, Gabriel N Hortobagyi, Thomas A Buchholz, y Wendy A Woodward. 2010. Prognostic factors of survival in the trastuzumab era among women with breast cancer and brain metastases who receive whole brain radiotherapy: a Single-Institution Review. Cancer 116, no. 13 (Abril 19): 3084-3092. doi:10.1002/cncr.25115.
Diéras, Véronique, y Jean-Yves Pierga. 2011. Brain metastasis of breast tumors and blood brain barrier. Bulletin Du Cancer 98, no. 4 (Abril 1): 385-389. doi:10.1684/bdc.2011.1336.
Dono, Mariella, Paola Ferro, Maria Cristiana Franceschini, Paolo Dessanti, Bartolomeo Bacigalupo, Eugenio Cibei, Cesare Capellini, et al. 2011. Human mammaglobin transcript amplification for differential diagnosis in a breast cancer metastatic to dura mater. Anticancer Research 31, no. 3 (Marzo): 1061-1064.
Gachet, Julie, Julie Giroux, Véronique Girre, Etienne Brain, Youlia Kirova, Laurent Mignot, Jean-Jacques Mazeron, et al. 2011. «Brain metastases in breast cancer. Epidemiology and natural history. The Institut Curie experience». Bulletin Du Cancer 98 (4) (Abril 1): 357-369. doi:10.1684/bdc.2011.1339.
Gerber, Sophie, Liliane Ollivier, Catherine Ala-Eddine, y Sylvia Neuenschwander. 2011. Brain metastasis of breast cancer; imaging evaluation. Bulletin Du Cancer 98, no. 4 (Abril 1): 399-407. doi:10.1684/bdc.2011.1346.
Gutierrez, Maya, Souad Lyazidi, Louis Brasseur, Frédérique Cvitkovic, y Romuald Le Scodan. 2011. Leptomeningeal meningitis related to breast cancer overexpressing HER2: is there a place for a more specific treatment? Bulletin Du Cancer 98, no. 4 (Abril 1): 417-424. doi:10.1684/bdc.2011.1341.
Lorger, M, H Lee, J S Forsyth, y B Felding-Habermann. 2011. Comparison of in vitro and in vivo approaches to studying brain colonization by breast cancer cells. Journal of Neuro-Oncology (Febrero 27). doi:10.1007/s11060-011-0550-4. http://www.ncbi.nlm.nih.gov/pubmed/21359851.
Musolino, Antonino, Laura Ciccolallo, Michele Panebianco, Elisa Fontana, Daniele Zanoni, Cecilia Bozzetti, Maria Michiara, Enrico Maria Silini, y Andrea Ardizzoni. 2011. Multifactorial central nervous system recurrence susceptibility in patients with HER2-positive breast cancer: epidemiological and clinical data from a population-based cancer registry study. Cancer 117, no. 9 (Mayo 1): 1837-1846. doi:10.1002/cncr.25771.
Phillips TL, Scott CB, Leibel SA, Rotman M, Weigensberg IJ. Results of a randomized comparison of radiotherapy and bromodeoxyuridine with radiotherapy alone for brain metastases: report of RTOG trial 89-05. Int. J. Radiat. Oncol. Biol. Phys. 33(2), 339–348 (1995).
Rades, Dirk, Jasmin N Evers, Theo Veninga, Lukas J A Stalpers, Radka Lohynska, y Steven E Schild. 2011. Shorter-course Whole-brain Radiotherapy for Brain Metastases in Elderly Patients. International Journal of Radiation Oncology, Biology, Physics (Abril 6). doi:10.1016/j.ijrobp.2011.01.058. http://www.ncbi.nlm.nih.gov/pubmed/21477949.
Oliveira, Mafalda, Sofia Braga, José Luís Passos-Coelho, Ricardo Fonseca, y João Oliveira. 2011. Complete response in HER2+ leptomeningeal carcinomatosis from breast cancer with intrathecal trastuzumab. Breast Cancer Research and Treatment 127, no. 3 (Junio): 841-844. doi:10.1007/s10549-011-1417-2.
Pelletier, Elise M, Boyung Shim, Seth Goodman, y Mayur M Amonkar. 2008. «Epidemiology and economic burden of brain metastases among patients with primary breast cancer: results from a US claims data analysis». Breast Cancer Research and Treatment 108 (2) (Marzo): 297-305. doi:10.1007/s10549-007-9601-0.
Rakha, E A, y S Chan. 2011. Metastatic Triple-negative Breast Cancer. Clinical Oncology (Royal College of Radiologists (Great Britain)) (Abril 23). doi:10.1016/j.clon.2011.03.013. http://www.ncbi.nlm.nih.gov/pubmed/21524569.
Villà, Salvador, Damien C Weber, Cristina Moretones, Anabel Mañes, Christophe Combescure, Josep Jové, Paloma Puyalto, et al. 2011. Validation of the new Graded Prognostic Assessment scale for brain metastases: a multicenter prospective study. Radiation Oncology (London, England) 6: 23. doi:10.1186/1748-717X-6-23.