Temozolomida
En 2002 Stupp y cols, publican sus resultados finales en un grupo de pacientes a los que se les administra Temozolamida concomitantemente con radioterapia como tratamiento de primera línea, en pacientes diagnosticados de glioblastoma de novo, mostrando su seguridad y eficacia, al prolongar la supervivencia global.
Ha mostrado una buena actividad como quimioterápico usado individualmente, un perfil de seguridad aceptable y beneficios en la supervivencia con AA recurrentes. Incluso el ensayo de la EORTC, que compara la supervivencia de los pacientes intervenidos de GM con Temozolamida adyuvante simultánea con radioterapia (RDT) (dosis de 75 mgr/día) seguido de TMZ a dosis de 200 mgr/día durante 6 ciclos (5 días de cada 28), frente a RDT sola, ha mostrado eficacia y aumento en la supervivencia.
Recientemente se ha identificado que los glioblastomas que contienen el gen MGMT (O6-methylguanine-DNA methyltransferase), reparador del ADN tumoral pueden beneficiarse con la Temozolamida.
El glioblastoma que contiene el gen MGMT (O6-methylguanine-DNA methyltransferase), reparador del ADN tumoral pueden beneficiarse con la temozolamida 1)
En 2005 ya se demostró que añadir TMZ al tratamiento de RT prolongaba la supervivencia media en 12,1-14,6 meses 2). 3), pero también facilitaba un fenómeno conocido como pseudoprogresión tumoral 4).
Indicaciones
La temozolamida ha sido aprobada en la Unión Europea para el tratamiento de pacientes con glioma maligno, tal como, glioblastoma multiforme o astrocitoma anaplásico, que presenta recurrencia o progresión después de la terapia estandar.
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico concomitante con radioterapia (RT) y posteriormente como tratamiento en monoterapia.
Niños a partir de tres años de edad, adolescentes y pacientes adultos con glioma maligno, tal como glioblastoma multiforme o astrocitoma anaplásico, que presentan recurrencia o progresión después de terapia estándar.
Historia
En 2002 Stupp y cols, publican sus resultados finales en un grupo de pacientes a los que se les administra Temozolamida (TMZ) concomitantemente con radioterapia como tratamiento de primera línea, en pacientes diagnosticados de glioblastoma de novo, mostrando su seguridad y eficacia, al prolongar la supervivencia global.
Si no existen complicaciones quirúrgicas se inicia entre la 3.a-4.a semana después de la cirugía (Stupp y col., 2009).
Mecanismo de acción
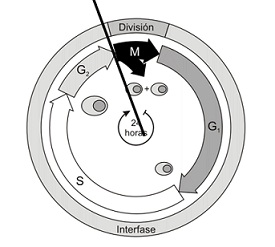
Es un agente alquilante cuyo mecanismo de acción consiste en inhibir la replicación del DNA y actuan por arresto del ciclo G2/M (Zhuang et al.2011).
Se transforma espontáneamente en el organismo en monometil triazenoimidazol carboxamida (MTIC), su metabolito activo, que resulta ser el mismo que el de la dacarbazina.
La activación de estos productos implica un proceso oxidativo con formación de un inestable metildiazonio, que es rápidamente escindido en nitrógeno molecular (N2) y un ion carbonio CH3+ que actúa como elemento “alquilante”.
Este ion carbonio provoca la metilación de algunas bases del ADN (fundamentalmente la guanina). Además, en el proceso oxidativo que conduce a la activación del fármaco puede formarse otros radicales libres capaces de provocar degradación del ADN e incluso roturas cromosómicas.
Posología
Protocolo de Stupp
Concomitante con la radioterapia: Diariamente 75 mg/m2, 1 hora antes de la radioterapia, incluso sábados y domingos hasta completar la RT.
Tras finalizar la RT, se administran dosis de 150 a 200 mg/m2/día, por 5 días consecutivos por ciclo.
Cada ciclo es de 28 días.
Se ha demostrado que el fármaco es activo frente a los gliomas malignos humanos cuando se administra por vía oral a la dosis de 200 mg/m2 una vez al día durante 5 días, repitiendo el ciclo cada 28 días.
Si el paciente ha sido previamente tratado con otros citostáticos se debe iniciar el primer ciclo de temozolamida a la dosis de 150 mg/m2 y en función del recuento de neutrófilos y plaquetas podrá incrementarse a 200 mg/m2 en sucesivos ciclos.
El fármaco no debe ser utilizado en niños menores de 3 años ya que no existe experiencia de uso.
Seguridad
Ha mostrado una buena actividad como quimioterápico usado individualmente, un perfil de seguridad aceptable y beneficios en la supervivencia con astrocitomas anaplásicos recurrentes. Incluso el ensayo de la EORTC, que compara la supervivencia de los pacientes intervenidos de GM con Temozolamida adyuvante simultánea con radioterapia (RDT) (dosis de 75 mgr/día) seguido de TMZ a dosis de 200 mgr/día durante 6 ciclos (5 días de cada 28), frente a RDT sola, ha mostrado eficacia y aumento en la supervivencia.
Resistencia
Aunque este agente quimioterapéutico, ha demostrado una prometedora actividad contra los gliomas, los efectos duran sólo unos meses y se desarrolla resistencia, en muchos casos.
Un creciente número de estudios indican que la expresión de la O (6)-metilguanina-ADN metiltransferasa (MGMT) es uno de los principales mecanismos responsables de este quimiorresistencia que podría superarse mediante la sincronización metronómica del régimen de TMZ con la expresión de MGMT (Pan y col., 2011).
Efectos adversos
Se ha demostrado que el fármaco es activo frente a los gliomas malignos humanos cuando se administra por vía oral a la dosis de 200 mg/m2 una vez al día durante 5 días, repitiendo el ciclo cada 28 días.
Si el paciente ha sido previamente tratado con otros citostáticos se debe iniciar el primer ciclo de temozolamida a la dosis de 150 mg/m2 y en función del recuento de neutrófilos y plaquetas podrá incrementarse a 200 mg/m2 en sucesivos ciclos.
El fármaco no debe ser utilizado en niños menores de 3 años ya que no existe experiencia de uso.
Tiene una biodisponibilidad oral prácticamente completa y atraviesa la barrera hematoencefálica.
Su biodisponibilidad céfalo-raquídea equivale al 30% de la plasmática Su Tmax es de 60 min y su semivida de eliminación de 109 min.
Los efectos adversos de la temozolamida han sido recogidos por el propio laboratorio Schering-Plough en base a 993 enfermos tratados a raíz de los distintos ensayos clínicos realizados.
Los efectos adversos más frecuentes son las náuseas (42%) y los vómitos (35% de los pacientes). La incidencia de náuseas o vómitos severos se ha cifrado en un 4%.
La mielosupresión severa con requerimientos de hospitalización o suspensión del tratameinto ha sido referenciada y se manifiesta fundamentalmente en forma de trombocitopenia (8 % de los pacientes) o neutropenia (4%).
La mielosupresión es dosis-limitante y no tiene carácter acumulativo.
Los casos de síndrome mielodisplásico, leucemia mieloide aguda, y leucemia linfoblástica aguda se están acumulando, especialmente los de leucemia mieloide aguda (Momota y col., 2013).
Otros efectos adversos descritos son: la fatiga (21%), el estreñimiento (15%) las cefaleas (13%), la anorexia (11%) y la diarrea (8%).
Se ha visto que el riesgo de neutro y trombocitopenia es mayor en pacientes con edad avanzada (> 70 años).
No debe utilizarse durante el embarazo y se desconoce si la temozolamida se elimina por la leche materna por lo que tampoco debe administrarse durante la lactancia.
La duración estimada del tratamiento es de 6 meses.
Concomitancia
Fase de radioterapia concomitante: Oral 75 mg diario por 42 días concomitantemente con radioterapia focal (60G y administrada en 30 fracciones) seguido por terapia de mantenimiento con temozolomida por 6 ciclos. La radioterapia focal incluye el lecho del tumor o el sitio de la resección con 2 a 3 cm de margen. No se recomiendan reducciones de dosis durante la fase concomitante; sin embargo, interrupción de dosis o discontinuación de las mismas pude producirse si se presenta toxicidad. La temozolomida debe ser continuada a través del período de tratamiento concomitante de 42 días si todas esta condiciones se presentan: recuento absoluto de neutrófilos > 1.5 x 109 por L. Recuento de plaquetas > 100 x 109 x L. Criterios Comunes de toxicidad (CTC) toxicidad no hematológica < grado 1 (excepto alopecia, náuseas y vómitos). La dosis de temozolomida debe ser interrumpida o discontinuada durante la fase concomitante de acuerdo con los criterios de toxicidad hematológica y no hematológica. Toxicidad TMZ Interrupción TMZ Discontinuación Recuento Absoluto de Neutrófilos > 0.5 y < 1.5 x 109) por L < 0.5 x 109 por L. Recuento de Plaquetas > 109 por recuento de plaquetas > 10 y < 100 x 109 por L CTC. Toxicidad No-hematológica (con excepción de CTC Grado 2, CTC Grado 3 ó 4 alopecia, náuseas, vómitos) TMZ= temozolomida; CTC = Criterios comunes de Toxicidad. Cuatro semanas después de completada la fase de temozolomida más radioterapia, temozolomida es administrado durante 6 ciclos adicionales de tratamiento de mantenimiento. Fase de Mantenimiento Ciclo 1: Oral, 150 mg por metro cuadrado 1 vez al día durante 5 días, seguido de 23 días sin tratamiento. Ciclos 2 hasta 6, Fase de Mantenimiento: Oral, 200 mg por m2, 1 vez al día, si todas las condiciones siguientes son cumplidas: Recuento de neutrófilos absolutos > 109 por litro. Recuento plaquetario > 100 x 109 por L. Ctc Toxicidad no Hematológica < grado 2 (salvo para alopecia, náuseas y vómitos). La dosis continúa en 200 mg por m2 durante los 5 primeros días de cada ciclo subsiguiente, salvo si ocurre toxicidad. Si la dosis no fue escalada en el Ciclo 2, no debe hacerse el aumento en ciclos subsiguientes. La dosis debe ser reducida a 100 mg por metro cuadrado, 1 vez al día debido a toxicidad previa. Las reducciones de dosis durante el ciclo siguiente deben estar basados en los recuentos sanguíneos más bajos y la peor toxicidad no-hematológica durante el ciclo antecedente.
Resultados
Los beneficios de la temozolomida adyuvante con radioterapia se prolongó a lo largo de 5 años de seguimiento.
Unos pocos pacientes en categorías de pronóstico favorable sobreviven más de 5 años.
El estado de metilación de MGMT identifica a los pacientes más susceptibles de beneficiarse de la adición de temozolomida (Stupp 2009).
En linfoma se apreció una respuesta completa en el 29% de los pacientes y fue bien tolerada sin efectos tóxicos serios (Makino y col., 2011).
Administración tanto endovenosa como por vía oral (Motomura y col., 2011).
Protocolo
Bibliografía
Makino, Keishi, Hideo Nakamura, Taku-Ichiro Hide, y Jun-Ichi Kuratsu. 2011. «Salvage treatment with temozolomide in refractory or relapsed primary central nervous system lymphoma and assessment of the MGMT status». Journal of Neuro-Oncology (Julio 1). doi:10.1007/s11060-011-0652-z. http://www.ncbi.nlm.nih.gov/pubmed/21720808.
Momota, Hiroyuki, Yoshitaka Narita, Yasuji Miyakita, and Soichiro Shibui. 2013. “Secondary Hematological Malignancies Associated with Temozolomide in Patients with Glioma.” Neuro-oncology (March 21). doi:10.1093/neuonc/not036.
Motomura, Kazuya, Atsushi Natsume, y Toshihiko Wakabayashi. 2011. «Intravenous administration of temozolomide as a useful alternative over oral treatment with temozolomide capsules in patients with gliomas». Journal of Neuro-Oncology (Julio 3). doi:10.1007/s11060-011-0651-0. http://www.ncbi.nlm.nih.gov/pubmed/21725854.
Pan, Q. et al., 2011. Chemoresistance to Temozolomide in Human Glioma Cell Line U251 is Associated with Increased Activity of O (6)-methylguanine-DNA Methyltransferase and Can be Overcome by Metronomic Temozolomide Regimen. Cell Biochemistry and Biophysics. Available at: http://www.ncbi.nlm.nih.gov/pubmed/21892781
Stupp, Roger, Pierre-Yves Dietrich, Sandrine Ostermann Kraljevic, Alessia Pica, Ivan Maillard, Phillipe Maeder, Reto Meuli, et al. 2002. Promising survival for patients with newly diagnosed glioblastoma multiforme treated with concomitant radiation plus temozolomide followed by adjuvant temozolomide. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology 20, no. 5 (Marzo 1): 1375-1382.
Zhuang, Dongxiao, Yingchao Liu, Ying Mao, Liang Gao, Haishi Zhang, Shihai Luan, Fengping Huang, y Qingquan Li. 2011. TMZ-induced PrPc/par-4 interaction promotes the survival of human glioma cells. International Journal of Cancer. Journal International Du Cancer (Febrero 15). doi:10.1002/ijc.25985. http://www.ncbi.nlm.nih.gov/pubmed/21328340.